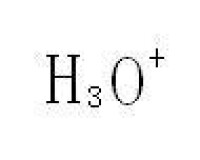水合氫離子指的是氫原子在失去電子后,通常用H3O表示,所以水的電離可以用以下方程式表示2H2O=H3O+OH。
水合氫離子是最簡單的氧鎓(釒羊)(Oxonium)。
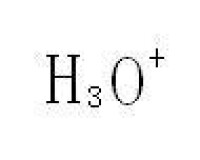
水合氫離子
水合氫離子,指的是氫原子在失去電子后,剩餘由1個
質子構成的核,即
氫離子,氫離子是“裸露”的質子,半徑很小,易被水分子吸引生成水合氫離子,通常用HO表,示,所以水的電離可以用以下方程式表示:2HO=HO+OH。
水(HO)的中心元素是O,O的最外層有6個電子,其中有一對在2s軌道,四個電子在2p軌道(其中一對電子在2px軌道,剩下兩個分別在2py和2pz),這裡面2py、2pz的那兩個電子分 別與氫成鍵,剩下一對電子對空餘。
水合氫離子是HO中,就是有一個H與空餘的2px軌道中的電子對成鍵所構成的(這裡面氫核周圍沒有電子,氧把兩個電子都給H,形成配位鍵),但不改變原來的sp3雜化。
實際上,水合氫離子在稀酸中進一步水合,以HO(即HO·3HO)形式存在,即三個HO的氧原子分別與HO中的三個氫形成氫鍵。
固態水合氫離子鹽
很多強酸都可能形成相對穩定的水合氫離子鹽晶體。這些鹽有時被稱為酸的一水合物。通常,任何具有109或更高的電離常數的酸都可以形成水合氫離子鹽。而電離常數小於109的酸一般不能形成穩定的HO鹽。
例如,
鹽酸的電離常數為107,在室溫下與水的混合物是液態的。而
高氯酸的電離常數為1010,如果液體
無水高氯酸和水以1:1的摩爾比結合,則反應形成固體一水合高氯酸,即高氯酸的水合氫離子鹽:
HO+HClO=HO·CLO
也有很多的含有水合的HO的例子,例如HCl·2HO中含有HO(HO·HO),HBr·4HO中含有HO(HO·2HO)和HO(HO·3HO)
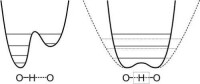
配位鍵形式
水合質子的結構問題一直是分析界的一大難題,質子在水中的狀態,並不是一般認為是HO的結構或者HO的結構,X射線衍射結果表明,存在的
氫鍵並不是傳統意義上的O——H···O,而 是O···H···O,後者擁有更短的O···O間距和更低的勢壘,使得質子可以輕易的在兩側勢井中移動,中間勢壘低,加上質子具有類似於電子透射勢壘的運動,使得質子被束縛在兩個氧之間,但是卻是非定域的。
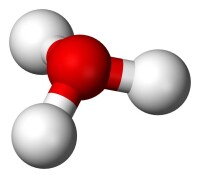
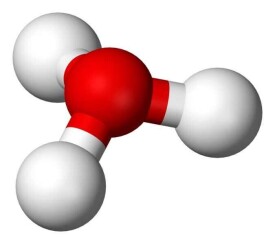
球棍模型
由於它是堆成結構,中間勢壘低,在低振動態的情況下,分子就可以越過勢壘,就會有很高的透射率。因此常溫下存在這種結構是可能的。
由於O和N原子具有相同的
電子數,因此HO與NH的電子數相等,從HO的球棍模型可以看出,其具有
氧原子位於頂點的三角錐形分子構型,H-O-H的夾角大約為113,同時質心非常靠近氧原子。因為金字塔的底部是由三個相同的氫原子組成的,HO分子的對稱頂部結構屬於C3v點群。因為這個對稱和它有偶極矩的事實,旋轉選擇規則是Δ =±1 和Δ =0。過渡
偶極子在c軸上,由於負電荷在氧原子附近,因此偶極矩指向頂點,垂直於基面。