高氯酸
無機化合物
高氯酸(perchloric acid)又名過氯酸,無機化合物,六大無機強酸之一,氯的含氧酸。高氯酸是無色透明的發煙液體,在無機含氧酸中酸性最強。高氯酸可助燃,具強腐蝕性、強刺激性,可致人體灼傷。工業上用於高氯酸鹽的製備,人造金剛石提純,電影膠片製造,醫藥工業,電拋光工業,用於生產砂輪,除去碳粒雜質,還可用作氧化劑等。
熔點:-112℃
沸點:203℃
密度:1.67g/cm
飽和蒸汽壓:2.00kPa(14℃)
折射率:1.419
強氧化劑。與還原性有機物、還原劑、易燃物如硫、磷等接觸或混合時有引起燃燒爆炸的危險。
在室溫下分解,加熱則爆炸(但市售恆沸高氯酸不混入可燃物則一般不會爆炸)。
無水物與水起猛烈作用而放熱。氧化性極強,具有強腐蝕性。
室溫時氧化活性很弱,但濃熱的高氯酸是強氧化劑可與大多數金屬包括金,銀髮生反應將他們氧化,生成對應的高價金屬高氯酸鹽和水。
強酸性:高氯酸是無機含氧酸中酸性最強的酸。
1、疏水參數計算參考值(XlogP):2.3
2、氫鍵供體數量:1
3、氫鍵受體數量:4
4、可旋轉化學鍵數量:0
5、互變異構體數量:0
6、拓撲分子極性表面積:71.4
7、重原子數量:5
8、表面電荷:0
9、複雜度:114
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:1
1、高氯酸和鹼金屬、鹼土金屬劇烈反應,猛烈爆炸,生成大量白霧。
2、稀的高氯酸和鎂、鋁等活潑金屬快速反應,生成大量氣泡,放出大量熱。
3、木炭、硫磺和純度較高的高氯酸反應,立刻發生烯燒然後爆炸。
4、高氯酸能鐵、鉻、鎳、鋅等劇烈反應生成氧化物,還能將元素磷和硫分別氧化成磷酸和硫酸。
5、室溫時氧化活性很弱,與Zn、Al、Cr等都不反應,與Sn、Ti、V反應緩慢,但濃熱的高氯酸是強氧化劑可與大多數金屬包括金,銀髮生反應將他們氧化,生成對應的高氯酸鹽和水。濃熱的高氯酸是強氧化劑可與大多數金屬包括金,銀髮生反應將他們氧化,生成對應的“高價金屬高氯酸鹽”和水。
高氯酸
高氯酸和硫酸鋇反應:HClO+BaSO→Ba(HSO4)(ClO)
高氯酸和氫氧化鈉反應(放出大量熱):NaOH+HClO→NaClO+HO
高氯酸和氟氣劇烈反應(爆炸):2F+2HClO→2HF+2FClO+O
氫氧化鎂和高氯酸反應:Mg(OH)+2HClO→Mg(ClO)+2HO
氫氧化鋁和高氯酸反應:Al(OH)+3HClO→Al(ClO4)+3HO
高氯酸和氨水反應(放出大量熱):HClO+NH·HO→NHClO+HO
高氯酸和鹽酸反應(氧化還原反應):HClO+7HCl→4Cl+4HO
氫氧化鉀和高氯酸反應(放出大量熱):KOH+HClO→KClO(微溶)+HO
乳酸鈉和高氯酸反應:CHONa+HClO→CHO+NaClO(如果高氯酸比較多,有可能把乳酸的醇羥基氧化為羧基,即變成丙酮酸)。
用於電鍍工業、電影膠片、人造金剛石工業、電拋光工業和醫藥工業。也用於生產砂輪除去碳粒雜質。用作強氧化劑。還用於生產煙花和炸藥。50%高氯酸用作丙烯腈聚合物的溶劑。是製造金屬高氯酸鹽的原料。可作化學分析試劑。
可作溶劑,例如可用作高效液相色譜以及丙烯腈聚合物的溶劑;作化學分析試劑,氧化劑,乾燥劑;可作原料,生產煙花,炸藥,金屬高鋁酸鹽。
健康危害:該品有強烈腐蝕性。皮膚粘膜接觸、誤服或吸入后,引起強烈刺激癥狀。
燃爆危險:該品助燃,具強腐蝕性、強刺激性,可致人體灼傷。
S23:Do not breathe gas/fumes/vapour/spray.不要吸入氣體/煙霧/蒸汽/噴霧。
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.眼睛接觸后,立即用大量水沖洗並徵求醫生意見。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the lable where possible).發生事故時或感覺不適時,立即求醫(可能時出示標籤)。
S36/37/39:Wear suitable protective clothing, gloves and eye/face protection.穿戴適當的防護服、手套和眼睛/面保護。
該品根據《危險化學品安全管理條例》受公安部門管制。
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗至少15分鐘。就醫。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:用水漱口,給飲牛奶或蛋清。就醫。
有害燃燒產物:氯化氫。
滅火方法:考慮到火場中可能存在有機物會引起爆炸,不可輕易接近。
滅火劑:霧狀水、泡沫、二氧化碳、砂土。
應急處理:迅速撤離泄漏污染區人員至安全區,並進行隔離,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。不要直接接觸泄漏物。勿使泄漏物與有機物、還原劑、易燃物接觸。儘可能切斷泄漏源。防止流入下水道、排洪溝等限制性空間。
小量泄漏:用砂土、乾燥石灰或蘇打灰混合。
大量泄漏:構築圍堤或挖坑收容。用泵轉移至槽車或專用收集器內,回收或運至廢物處理場所處置。

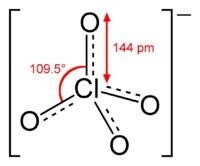
各氧化態氯酸的空間構型圖及其各電勢
儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。保持容器密封。應與酸類、鹼類、胺類等分開存放,切忌混儲。儲區應備有泄漏應急處理設備和合適的收容材料。
高氯酸鈉法將氯酸鈉在溶解槽內加水,通入蒸汽於45~50℃下溶解,使其飽和后加入氫氧化鋇除去鉻酸根等雜質,經壓濾,清液送去電解,製得高氯酸鈉。把高氯酸鈉加入反應器,再加入31%鹽酸(用量為理論量的110%~120%)進行複分解反應,生成高氯酸,過濾除去氯化鈉結晶,濾液經蒸發濃縮至高氯酸含量60%以上,製得工業高氯酸。其化學方程式為:
NaClO₃+H₂O→NaClO₄+H₂↑
NaClO₄+HCl→HClO₄+NaCl
工業上使用電解氯酸鈉的方法生產高氯酸鈉,高氯酸可由高氯酸鈉和濃硫酸經複分解反應製備:
NaClO₄+H₂SO₄(濃)→NaHSO₄+HClO₄(易爆)
還有高氯酸鋇和硫酸反應過濾,以及用硝酸氧化氯酸銨都可製備高氯酸
上游原料:氯酸鈉、鹽酸
下游產品:高氯酸鋰、高氯酸、過氧化二異丙苯
謠言:高氯酸和鹽酸反應(氧化還原反應):HClO₄+7HCl→4Cl₂+4H₂O
駁斥:高氯酸與鹽酸並不容易反應,甚至鹽酸可以用來製備高氯酸:
高氯酸鈉與鹽酸相互作用可製得70% HClO4溶液。在攪拌下向260mL鹽酸(相對密度1.19)中慢慢加入130g NaClO4(在負壓下)。混合物在攪拌下放置4~8h,用砂芯漏斗過濾,用30~40mL鹽酸洗滌沉澱。將濾液與洗滌水合併,在減壓下蒸發直到除去Cl(用AgNO3檢驗)。此時會有HClO4的白色蒸氣出現。再將溶液冷卻,通過砂芯漏斗濾出少量未反應的NaClO4,得到的150g HClO4相對密度1.6。用蒸餾法精製。用磨口裝置在1999.5~266.4Pa 48~54℃蒸出帶有痕量HClO4的水。在107~111℃,蒸出70~72℃的HClO4。
即使高氯酸氧化鹽酸,也會形成大量二氧化氯,而不是單純形成氯氣-這也是上述方法製備的高氯酸中的雜質。