配位鍵
一種特殊的共價鍵
徠配位鍵,又稱配位共價鍵,是一種特殊的共價鍵。當共價鍵中共用的電子對是由其中一原子獨自供應時,就稱配位鍵。配位鍵形成后,就與一般共價鍵無異。成鍵的兩原子間共享的兩個電子不是由兩原子各提供一個,而是來自一個原子。例如氨和三氟化硼可以形成配位化合物,在N和B之間的一對電子來自N原子上的孤對電子。
一種共價鍵,成鍵的兩原子間共享的兩個電子不是由兩原子各提供一個,而是來自一個原子。例如,氨和三氟化硼可以形成配位化合物:
式中→表示配位鍵。在N和B之間的一對電子來自N原子上的孤對電子。
配位鍵是極性鍵,電子總是偏向一方,根據極性的強弱,或接近離子鍵,或接近極性共價鍵。在一些配合物中,除配體向受體提供電子形成普通配位鍵外,受體的電子也向配體轉移形成反饋配鍵,例如中碳上的孤對電子向鎳原子配位形成σ配位鍵,鎳原子的d電子則反過來流向 反鍵軌道,形成四電子三中心鍵,就是反饋配鍵,非金屬配位化合物中也可能存在這種鍵。配位鍵可用以下三種理論來解釋:
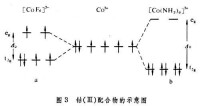
價鍵理論認為配體上的電子進入中心原子的雜化軌道。例如,鈷(Ⅲ)的配合物可用圖 1表示。的孤對電子進入雜化軌道,這種配合物稱為外軌配合物或高自旋配合物。它與自由Co3+離子一樣,有四個未成對電子,因而是順磁性的。的孤對電子進入雜化軌道,這種配合物稱為內軌配合物或低自旋配合物,由於所有電子都已成對,因而沒有順磁性而為抗磁性。
這個理論解釋了配合物的立體化學和磁性質,但沒有考慮激發態,也不能說明配合物的光譜等性質(見外軌配合物和內軌配合物)。
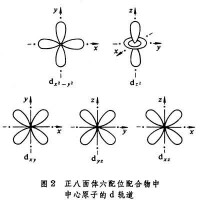
將配體看作點電荷或偶極子,來考慮配體產生的靜電場對中心原子的原子軌道能級的影響。例如,把中心原子引入位於正八面體六個頂角上的六個配體中,原來五重簡併的d軌道就分裂成一組二重簡併的軌道和一組三重簡併的軌道。eg軌道直接指向位於頂角上的配體, 由於排斥作用,比不指向配體的t2g軌道有較高的能量(圖2)。上述鈷(Ⅲ)配合物可用圖3表示。eg和t2g軌道的能量差,稱為分離能墹0,墹0呏10Dq,Dq稱為場強參量。6個F- 產生的場不強,墹0較小,d電子按照洪德規則排布如圖3a,有四個未成對電子,因而為弱場配合物或高自旋配合物。6個NH3產生的場較強,墹0較大,d電子按照能量最低原則和泡利原理排布如圖3b,沒有未成對電子,因而為強場配合物或低自旋配合物。理論上場強參量可用公式或來計算,式中q和μ為配體的電荷和偶極矩;R 為中心原子和配體的矩離;〈r4 〉為中心原子d軌道中的電子和原子核之間的距離的四次方的期望值。實際上,Dq常作為一種經驗參量,由擬合光譜數據得出。
配位鍵
配位鍵
晶體場理論較合理地解釋了配合物的磁性質和電子光譜,是研究配位化學最重要的理論。由於只考慮中心原子的電子結構,沒有考慮配體的結構,不適用於烯烴配合物和零價金屬配合物。分子軌道理論 假定電子是在分子軌道中運動,應用群論或根據成鍵的基本原則(對稱性原則,能量相近原則和最大重疊原則)就可得出分子軌道能級圖。再把電子從能量最低的分子軌道開始按照泡利原理逐一填入,即得分子的電子組態。分子軌道可以近似地用原子軌道線性組合而成。分子軌道可以分為成鍵軌道和反鍵軌道。分子的鍵合程度取決於分子中成鍵電子數與反鍵電子數之差。分子軌道理論更全面地討論了配合物的結構,但計算工作量很大,常不得不引進各種不同程度的近似。
參考書目
戴安邦主編:《配位化學》(無機化學叢書),科學出版社,北京,1987。
假定電子是在分子軌道中運動,應用群論或根據成鍵的基本原則就可得出分子軌道能級圖。再把電子從能量最低的分子軌道開始按照泡利原理逐一填入,即得分子的電子組態。分子軌道分為成鍵軌道和反鍵軌道。分子的鍵合程度取決於分子中成鍵電子數與反鍵電子數之差。
(1) O原子可以提供一個空的2p軌道,接受外來配位電子對而成鍵,如在有機胺的氧化物中。
(2) O原子既可以提供一個空的2p軌道,接受外來配位電子對而成鍵,也可以同時提供二對孤電子對反饋給原配位原子的空軌道而形成反饋鍵,如在中的反饋鍵稱為d-p 鍵,鍵仍只具有雙鍵的性質。
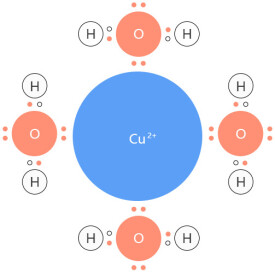
配位共價鍵簡稱“配位鍵”是指兩原子的成鍵電子全部由一個原子提供所形成的共價鍵,其中,提供所有成鍵電子的稱“配位體(簡稱配體)”、提供空軌道接納電子的稱“受體”。常見的配體有:氨氣(氮原子)、一氧化碳(碳原子)、氰根離子(碳原子)、水(氧原子)、氫氧根(氧原子);受體是多種多樣的:有氫離子、以三氟化硼(硼原子)為代表的缺電子化合物、還有大量過渡金屬元素。對配位化合物的研究已經發展為一門專門的學科,配位化學。
參見“路易斯酸”、“路易斯鹼”從上面的內容可以看出,“氫氧根”屬於配體、而“氫離子”屬於受體,這表明,氫離子與氫氧根發生的酸鹼中和反應可以看成是氫離子與氫氧根形成配位鍵的過程。化學家路易斯從這一點出發,提出了“路易斯酸”與“路易斯鹼”的概念,認為凡是在配位鍵成鍵過程中,能給出電子的,都稱為“鹼”;能接納電子的,都稱為“酸”。路易斯的酸鹼理論把酸和鹼的範圍擴大了,路易斯酸鹼對不僅包括所有的的阿倫尼烏斯酸鹼對,還包括一些中性甚至是根本不溶於水的物質。
其實,路易斯酸的本質是配位鍵中的“受體”;路易斯鹼的本質是配位鍵中的“配體”,二者是等同的。
路易斯酸
配位鍵與共價鍵的本質是否相同
原子之間形成共價鍵時,若共用電子對只是由一方原子提供電子,而非來自雙方原子,這樣的共價鍵就稱為配位鍵,故配位鍵一定是共價鍵,也就具有共價鍵的特徵:方向性與飽和性,所以說配位鍵與共價鍵沒有本質上的差異。
共價鍵不一定是配位鍵,關鍵是看共用電子對的來源是一個成鍵原子還是兩個成鍵原子提供的,若是由成鍵的一個原子單方面提供的則為配位鍵,若是由成鍵雙方原子共同提供的則是普通共價鍵,所以說配位鍵與共價鍵只是在形成過程上有所不同而已。
形成配位鍵有何條件
配位鍵是一種特殊的共價鍵,並不是任意的兩個原子相遇就能形成。它要求成鍵的兩個原子中一個原子A有孤對電子,另一個原子B有接受孤對電子的“空軌道”,所以配位鍵的表示方法為,徠A稱為配體,B稱為中心原子或離子。有時為了增強成鍵能力,中心原子或離子B利用能量相近的空軌道進行雜化后,再來接收以配體原子A的孤電子對。配位鍵既可以存在於分子中(如等),又可以存在於離子之中(如銨根離子、水合氫離子等)。