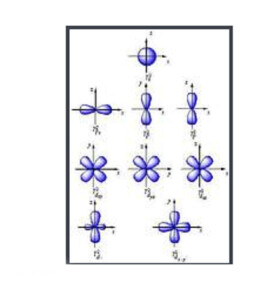
原子軌道
單電子薛定諤方程的合理解ψ
原子軌道(Atomic orbital)是單電子薛定諤方程的合理解ψ(x,y,z)。若用球坐標來描述這組解,即ψ(r,θ,φ)=R(r)·Y(θ,φ),這裡R(r)是與徑向分佈有關的函數,稱為徑向分佈函數,用圖形描述就是原子軌道的徑向分佈函數;Y(θ,φ)是與角度分佈有關的函數,用圖形描述就是角度分佈函數。

電子的原子與分子軌道,依照能階排序
現今普遍公認的原子結構是波耳氫原子模型:電子像行星,繞著原子核(太陽)運行。然而,電子不能被視為形狀固定的固體粒子,原子軌道也不像行星的橢圓形軌道。更精確的比喻應是,大範圍且形狀特殊的“大氣”(電子),分佈於極小的星球(原子核)四周。只有原子中存在唯一電子時,原子軌道才能精準符合“大氣”的形狀。當原子中有越來越多電子時,電子越傾向均勻分佈在原子核四周的空間體積中,因此“電子云”越傾向分佈在特定球形區域內(區域內電子出現機率較高)。
早在1904年,日本物理學家長岡半太郎首度發表電子以類似環繞軌道的方式在原子內運轉的想法。1913年,丹麥物理學家尼爾斯·波耳提出理論,主張電子以固定的角動量環繞著體積極小的原子核運行。然而,一直到1926年、量子力學發展后,薛定諤方程式才解釋了原子中的電子波動,定下關於新概念“軌道”的函數。
由於這個新概念不同於古典物理學中的軌道想法,1932年美國化學家羅伯特·馬利肯提出以“軌道”(orbital)取代“軌道”(orbit)一詞。原子軌道是單一原子的波函數,使用時必須代入n(主量子數)、l(角量子數)、m(磁量子數)三個量子化參數,分別決定電子的能量、角動量和方位,三者統稱為量子數。每個軌道都有一組不同的量子數,且最多可容納兩個電子。s軌道、p軌道、d軌道、f軌道則分別代表角量子數l=0, 1, 2, 3的軌道,表現出如右圖的軌道形狀及電子排布。它的名稱源於對其原子光譜特徵譜線外觀的描述,分為銳系光譜(sharp)、主系光譜(principal)、漫系光譜(diffuse)、基系光譜(fundamental),其餘則依字母序命名(跳過 j)。
在原子物理學的運算中,複雜的電子函數常被簡化成較容易的原子軌道函數組合。雖然多電子原子的電子並不能以“一或二個電子之原子軌道”的理想圖像解釋,它的波函數仍可以分解成原子軌道函數組合,以原子軌道理論進行分析;就像在某種意義上,由多電子原子組成的電子云在一定程度上仍是以原子軌道“構成”,每個原子軌道內只含一或二個電子。
參見“電子層”
原子核外運動的電子繞核運動會受到原子核的吸引,他們運動能量上的差異可用他們運動軌道離核的遠近表現出來。具有動量較大的電子在離核越遠的地方運動,而動量較小的則在離核較近的地方運動。但是電子繞核運動與人造衛星繞地球運動不同。人造衛星繞地球運動的動量是連續變化的,由於能量的消耗,它的軌道會逐漸接近地球。但原子的能量是量子化的,原子核外電子運動的軌道是不連續的,他們可以分成好幾層,這樣的層,稱為“電子層”,也稱“能層”
。

氫原子光譜的巴爾默系
。
通常情況下,氫原子的電子在離核最近的電子層上運動,這時並不放出能量,此時的電子所處的狀態稱為“基態”。當氫原子從外界獲得能量(如灼熱、放電、輻射能等),它的電子可以躍遷到離核較遠的電子層上,此時的電子所處的狀態稱為“激發態”。當電子從離核較遠的電子層躍遷到能量相對更低也離核更近的電子層時,就會以光的形式放出能量。光的頻率ν和兩電子層的能量差∣E2-E1∣有下列關係
:
hv=∣E2-E1∣
其中,h為普朗克常數(6.62×10^-27爾格·秒)
因為電子層是不連續的所以電子躍遷放出的能量也是不連續的(量子化的),這種不連續的能量在光譜上的反映就是線狀光譜。
在現代量子力學模型中,描述電子層的量子數稱為主量子數(principal quantum number)或量子數n,n的取值為正整數1、2、3、4、5、6、7,對應符號為K、L、M、N、O、P、Q。對氫原子來說,n一定,其運動狀態的能量一定。一般而言:n越大,電子層的能量越高。
每個電子層所容納的電子個數有限,為2n^2個,但當一個電子層是原子的最外層時,它至多只能容納8個電子,次外層最多容納18個
。
| 主量子數 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 電子層 | K | L | M | N | O | P | Q |
| 0族電子數 | 2 | 2,8 | 2,8,8 | 2,8,18,8 | 2,8,18,18,8 | 2,8,18,32,18,8 | 2,8,18,32,32,18,8 |
如果一個電子在激發態,一個有著恰當能量的光子能夠使得該電子受激輻射,釋放出一個擁有相同能量的光子,其前提就是電子返回低能級所釋放出來的能量必須要與與之作用的光子的能量一致。此時,受激釋放的光子與原光子向同一個方向運動,也就是說這兩個光子的波是同步的。利用這個原理,人們設計出了激光,它是可以產生頻率很窄的光的光源。
在越來越多的光譜實驗中,人們發現,電子在兩個相鄰電子層之間發生躍遷時,會出現多條相近的譜線,這表明,同一電子層中還存在著能量的差別,這種差別,就被稱為“電子亞層”,也叫“能級”。

原子軌道能級圖
由一個或多個能級組成,同一能級的能量相同。
描述能級的量子數稱為角量子數(angular quantum number)用“l”表示。對於每一個電子層對應的主量子數n,l的取值可以是0、1、2、n-1,也就是說,總共有n個能級,因為第一電子層K的n=1,所以它只有一個能級,而n=2的L層就有兩個能級,表現在光譜上就是兩條非常相近的譜線。
從第一到第七周期的所有元素中,人們共發現4個能級,分別命名為s,p,d,f。從理論上說,在第八周期將會出現第五個能級。
| 主量子數n | 1 | 2 | 3 | 4 |
| 電子層 | K | L | M | N |
| 角量子數(l)取值 | 0,1 | 0,1,2 | 0,1,2,3 | |
| 能級符號 | 1s | 2s,2p | 3s,3p,3d | 4s,4p,4d,4f |
能級分裂
在多電子原子中,當價電子進入原子實內部時,內層電子對原子核的屏蔽作用減小,相當於原子實的有效電荷數增大,也就是說電子所受到的引力增大,原子的體系能量下降,所以由此可以容易得出,當主量子數n相同時,不同的軌道角動量數l所對應的原子軌道形狀不一樣,即當價電子處於不同的軌道時,原子的能量降低的幅度也不一樣,軌道貫穿的效果越明顯,能量降低的幅度越大。
s,p,d,f能級的能量有大小之分,這種現象稱為“能級分裂”,屏蔽效應產生的主要原因是核外電子間靜電力的相互排斥,減弱了原子核對電子的吸引:s能級的電子排斥p能級的電子,把p電子“推”離原子核,p、d、f之間也有類似情況
總的屏蔽順序為:ns>np>nd>nf
因為離核越遠,能量越大,所以能量順序與屏蔽順序成反比
能量順序為:ns
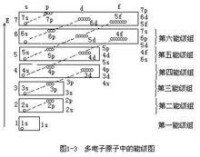
鮑林的近似能級圖
同一電子層之間有電子的相互作用,不同電子層之間也有相互作用,這種相互作用稱為“鑽穿效應”。其原理較為複雜,鑽穿效應的直接結果就是上一電子層的d能級的能量高於下一電子層s的能量。即,d層和s層發生交錯,f層與d層和s層都會發生交錯。
我國化學家徐光憲提出了一條能級計算的經驗定律:能級的能量近似等於n+0.7l。
美國著名化學家萊納斯·鮑林也通過計算給出了一份近似能級圖(見右圖)這幅圖近似描述了各個能級的能量大小,有著廣泛的應用
。
在外部磁場存在的情況下,許多原子譜線還是發生了更細的分裂,這個現象被叫做塞曼效應(因電場而產生的裂分被稱為斯塔克效應),這種分裂在無磁場和電場時不存在,說明,電子在同一能級雖然能量相同,但運動方向不同,因而會受到方向不同的洛倫茲力的作用。這些電子運動描述軌道的量子數稱為磁量子數(magnetic quantum number)符號“m”,對於每一個確定的能級(電子亞層),m有一個確定的值,這個值與電子層無關(任何電子層內的能級的軌道數相同)。
| 能級 | s | p | d | f |
| 磁量子數 | 1 | 3 | 5 | 7 |
| 軌道數 | 1 | 3 | 5 | 7 |
軌道的形狀可以根據薛定諤方程球坐標的Y(θ,φ)推算,s能級為一個簡單的球形軌道。p能級軌道為啞鈴形,分別佔據空間直角坐標系的x,y,z軸,即有三個不同方向的軌道。d的軌道較為複雜,f能級的七個軌道更為複雜。所有軌道的角度分佈波函數圖像參見a gallery of atomic orbitals and molecular orbitals
。
高分辨光譜事實揭示核外電子還存在著一種奇特的量子化運動,人們稱其為自旋運動,用自旋磁量子數(spin m.q.n)表示,每個軌道最多可以容納兩個自旋相反的電子。記做“↑↓”但需要指出,這裡的自旋和地球的自轉不同,自旋的實質還是一個等待發現的未解之謎
。“自旋”我們是借用我們平常能理解的名詞,實際上是電子的一種內稟運動。
原子核也可以存在凈自旋。由於熱平衡,通常這些原子核都是隨機朝向的。但對於一些特定元素,例如氙-129,一部分核自旋也是可能被極化的,這個狀態被叫做超極化,在核磁共振成像中有很重要的應用。
電子在原子軌道的運動遵循三個基本定理:能量最低原理、泡利不相容原理、洪德定則。
能量最低原理的意思是:核外電子在運動時,總是優先佔據能量更低的軌道,使整個體系處於能量最低的狀態。
原子軌道
多容納兩個自旋相反的電子。該原理有兩個推論:
①若兩電子處於同一軌道,其自旋方向一定不同;
②若兩個電子自旋相同,它們一定不在同一軌道;
③每個軌道最多容納兩個電子。
洪特在總結大量光譜和電離勢數據的基礎上提出洪德規則(Hund's rule):電子在簡併軌道上排布時,將儘可能分佔不同的軌道,且自旋平行
。對於同一個電子亞層,當電子排布處於
全滿(s^2、p^6、d^10、f^14)
半滿(s^1、p^3、d^5、f^7)
全空(s^0、p^0、d^0、f^0)
時比較穩定。
最初人們只是用電子結構示意圖來表示原子的微觀結構,但電子結構示意圖只能表示出原子的電子層而不能表示出能級和軌道,電子排布式由此誕生
。
電子排布式的表示方法為:用能級符號前的數字錶示該能級所處的電子層,能級符號后的指數表示該能級的電子數,電子依據“能級交錯”后的能級順序順序和“能量最低原理”、“泡利不相容原理”和“洪德規則”三個規則進行進行。另外,雖然電子先進入4s軌道,後進入3d軌道(能級交錯的順序),但在書寫時仍然按1s∣2s,2p∣3s,3p,3d∣4s的順序進行。
示例
H:1s^1
F:1s^2∣2s^2,2p^5
S:1s^2∣2s^2,2p^6∣3s^2,3p^4
Cr:1s^2∣2s^2,2p^6∣3s^2,3p^6,3d^5∣4s^1(注意加粗數字,是3d^5,4s^1而不是3d^4,4s^2,因為d軌道上,5個電子是半充滿狀態,這裡體現了洪德規則)。
簡化電子排布式
為了書寫方便,通常還會將電子排布式進行簡化,用稀有氣體結構代替已經充滿的電子層
示例
Cr:1s^2∣2s^2,2p^6∣3s^2,3p^6,3d^5∣4s^1
簡化后:Cr:[Ar]3d^5∣4s^1(因為Ar:1s^2∣2s^2,2p^6∣3s^2,3p^6)
簡化后剩下的電子排布部分是價電子,會參與化學反應,在元素周期表中有標示。