鎄
鎄
鎄(台灣、香港、澳門稱鑀,舊譯作釾)(Einsteinium)是一種人工合成元素,符號為Es,原子序為99。鎄是第7個超鈾元素,屬於錒系元素。1952年12月由加州大學伯克利分校物理學家吉奧索等人首次發現。
鎄是在1952年第一次氫彈爆炸的殘餘物中發現的,並以物理學家阿爾伯特·愛因斯坦命名。其最常見的同位素為鎄-253(半衰期為20.47天),是通過鐦-253的衰變而人工製造的,每年在高能核反應爐中的產量約為1毫克。合成之後,鎄-253要從其他錒系元素及其衰變產物中分離出來,這是個複雜的過程。其他的鎄同位素則在各個實驗室中以較輕元素的離子撞擊錒系元素而合成,但產量少得多。鎄除了用於合成新的元素,主要用於發射X射線。鎄曾在1955年用於首次合成鍆元素,並一共合成了17顆鍆原子。
鎄是一種柔軟的銀白色金屬,具順磁性。其化學屬性符合典型的重錒系元素,容易形成+3氧化態,並特別在固體中也可以形成+2態。鎄-253的高放射性會使它明顯地發光,並會迅速破壞其晶體金屬結構,每克釋放大約1000瓦的熱量。由於鎄-253每天都損失3%的質量,並依次衰變為錇和鐦,因此對鎄的研究十分困難。鎄-252是存留時間最長的鎄同位素(半衰期為471.7天),可以用於研究鎄的物理特性,但生產鎄-252是極為困難的,每次的產量也極少。鎄是最後一種曾在宏觀尺度下以純元素形態被研究過的元素,所用的同位素是常見但半衰期短的鎄-253。和其他的人工合成超鈾元素一樣,鎄是極具放射性的,如果進食了會對健康造成損害。
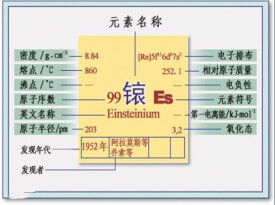
| 中文名稱 | 鎄 |
| 英文名稱 | Einsteinium |
| 原子序數 | 99 |
| 原子量 | [252] |
| 電子排布 | [Rn] 5f 7s |
| 核外電子排布 | 2,8,18,32,29,8,2 |
| 所屬周期 | 7 |
| 所屬族 | ⅢB |
| 化合價 | 0,+2,+3,+4 |
| 密度(室溫下) | 8.84 g·cm |
| 電負性(Pauling標度) | 1.3 |
| 熔點 | 1133K |
| 第一電離能 | 6300 KJ·mol |
| 晶體結構 | 六方晶系(室溫)面心立方晶體(300℃) |
| 磁(性 | 順磁性 |
| CAS號 | 7429-92-7 |
標準電極電勢
大約300 µg的Es因強烈輻射而發光。鎄是一種銀白色的放射性金屬。在元素周期表中,鎄位於鐦之右,鐨之左,鈥之下。其物理及化學特性與鈥有許多共通之處。其密度為8.84 g/cm,這比鐦的密度低(15.1 g/cm),但與鈥的密度相約(8.79 g/cm)。鎄的熔點(860 °C)比鐦(900 °C)、鐨(1527 °C)及鈥(1461 °C)的熔點低。鎄是一種柔軟的金屬,其體積模量只有15 GPa,是非鹼金屬中該數值最低的元素之一。
與更輕的錒系元素鐦、錇、鋦及鎇不同的是,鎄不呈雙六方晶體結構,而是呈面心立方結構。其空間群為Fm3m,點陣常數為a = 575 pm。但是有研究稱,鎄能夠在室溫下形成六方晶體,a = 398 pm,c = 650 pm,但在加熱到300 °C之後便轉變為面心立方結構。
鎄的放射性非常強,使其自身的晶體結構迅速受輻射破壞;每克Es會通過輻射釋放1000瓦的能量,足以產生肉眼可見的亮光。這也可能是鎄擁有低密度、低熔點的原因。由於可用樣本稀少,所以鎄的熔點是通過觀察在電子顯微鏡下對鎄進行加熱而推導出的。少量樣本中的表面效應會降低熔點值。
鎄的化合價為二,而且具高揮發性。為了減少輻射對鎄自身的破壞,大部分對固體鎄及其化合物的測量都在熱退火之後馬上進行。某些鎄化合物是在還原性氣體中研究的,如H2O+HCl用於研究EsOCl,這樣化合物在分解的同時,也會重新形成。
除了輻射導致的自我破壞以外,鎄的稀少和迅速衰變也對研究造成了困難。最常見的同位素Es每年只生產一到兩次,每次份量不超過1毫克。每1天有3.3%的鎄轉變為錇,再轉變為鐦:
因此大部分被研究的鎄樣本都受到了其他物質的污染,而其本身的屬性則是通過長期積累數據推導而得。其他避過污染問題的實驗方法包括用可調諧激光選擇性地只激發鎄離子,這種方法被用於研究鎄的發光屬性。
對鎄金屬、其氧化物及氟化物磁性的研究指出,這三種物質從在液態氫中到室溫中均顯示出居裡外斯順磁性。推導出的Es2O3的有效磁矩為10.4 ± 0.3 µB,EsF3的為11.4 ± 0.3 µB。這兩個值是錒系元素中最高的,相對應的居里點分別為53和37 K。
化學元素[周期系第Ⅲ族(類)副族元素、錒系元素]。和所有錒系元素一樣,鎄在化學上非常活潑。與氟化鐦或氫氧化鐦共沉澱。化學性質似稀土元素。其+3氧化態在固體及水溶液中最為穩定,並呈綠色。在固體中,強還原條件下,鎄還可以形成+2態。這種+2態在許多別的錒系元素中是不存在的,包括鏷、鈾、鎿、鈈、鋦和錇。Es化合物可以通過使用二氯化釤還原Es來取得。氣態化學研究臆測可能存在+4態,但這仍待證實。基態電子構型為1s2s2p3s3p3d4s4p4d4f5s5p5d5f6s6p7s。
據《自然》網站報道,美國研究人員首次揭示了元素周期表中最神秘且最重的元素之一——鎄的基本化學性質。這一成就使化學家們離發現所謂的“穩定島”更近了一步。“穩定島”意味著元素的維持時間足以進行研究和使用。
美國加州大學勞倫斯·伯克利國家實驗室研究人員造出了233納克純鎄樣品,並進行了自上世紀70年代以來的首次實驗,由此發現了該元素的一些基本化學性質。
研究人員測量出了鎄的化學鍵長度(兩個鍵原子之間的平均距離),這是一種基本的化學性質,可以幫助科學家預測其將如何與其他元素相互作用。他們還發現,鎄的鍵長與錒系元素的總體趨勢背道而馳。這是過去理論上已經預測過的,但從未在實驗中被證明。
與其他錒系元素相比,鎄暴露於光線時的發光能力也大不相同,研究人員將其描述為“前所未有的物理現象”,需要進一步實驗以確定原因。
鎄已知共有19種同位素及3種同核異構體,原子量從240到258不等。它們全都具有放射性,其中最穩定的同位素為Es,半衰期為471.7天。其他較穩定的同位素包括Es(半衰期為275.7天)、Es(39.8天)及Es(20.47天)。其餘所有的同位素半衰期都在40小時以下,大部分的在30分鐘以下。三種同核異構體中,最穩定的為Es,其半衰期為39.3小時。
鎄具有高核裂變率,因此要持續核連鎖反應所需的臨界質量很低。一個純Es同位素球體的臨界質量為9.89公斤,只要加上一條30厘米長的鋼條或水反射層就能把臨界值降到2.9甚至2.26公斤。然而,這一數值遠比總共製造出的鎄元素要多,其中Es的總產量則更少。
由於鎄的所有同位素半衰期都很短,所以一切原始的鎄核素,也就是在地球形成時可能存在的鎄,至今都已全部衰變。鎄也可以通過地殼中錒系元素(鈾和釷)的多次中子捕獲產生,但這發生的可能性極低。因此地球上幾乎所有的鎄都是在科學實驗室、高能核反應爐或是核武器試驗中產生的,並在合成后只存留不超過幾年的時間。鎄和鐨曾在位於加彭奧克洛的天然核反應堆中自然產生,但至今已不再形成了。
有關鎄毒性的數據主要來自對動物的研究。當老鼠進食了鎄以後,只有大約0.01%的鎄進入了血液。進入血液的鎄中有65%進入了骨骼,並存留大約50年;25%進入了肺部,生物半衰期約為20年。但由於鎄本身半衰期更短,所以這些數值是沒有實際關係的。另外0.035%進入了睾丸或0.01%進入卵巢,並永久存留。進食的量中大約10%被排放出來。鎄在骨骼表面均勻分佈,這和進食了鈈后的結果相同。
| 同位素 | 半衰期 |
| Es | 471.7d |
| Es | 20.47d |
| Es | 257.7d |
| Es | 39.8d |
| 同位素 | 半衰期 | 同位素 | 半衰期 |
| Es | 1s | Es | 27min |
| Es | 10s | Es | 102.2min |
| Es | 13.5s | Es | 8.6h |
| Es | 21s | Es(核同質異能素) | 2.22h |
| Es | 37s | Es | 33h |
| Es | 1.1min | Es(核同質異能素) | 39.3h |
| Es | 7.7min | Es | 25.4min |
| Es | 4.5min | Es(核同質異能素) | 7.6h |
| Es | 7.7d | Es | 3min |
鎄是在核反應堆中通過對錒系元素進行中子撞擊而產生的。鎄元素的主要來源是位於美國田納西州橡樹嶺國家實驗室的85 MW高通率同位素反應爐(HFIR),以及位於俄羅斯季米特洛夫格勒核反應器研究所(NIIAR)的SM-2環流反應器。這兩個反應器都是專門用於製造超鋦元素的(Z > 96)。兩座設施的功率和通量相約,所以兩者對超鋦元素的生產量應該是相約的,但文獻較少報道NIIAR所生產的超鋦元素。該實驗室通過對鋦進行輻射,一般每次可生產數十克(1×10 g)鐦、數毫克(1×10 g)錇和鎄以及數皮克(1×10 g)鐨。
HFIR在1961年首次製成微量的Es,樣本大約重10納克(1×10 g)。研究人員使用了一種特殊的磁秤來估計樣本的重量。之後的單次產量增加到1967年至1970年的0.48毫克,然後到1971年至1973年的3.2毫克,再到1974年至1978年的每年3毫克產量。這些數值指的是剛剛完成輻射時的鎄元素總量,而接著的分離過程會將純鎄的量降低大約10倍。Es、Fm及Fm不會形成,因為Cf和Es不會進行β衰變。
對鈈進行強烈的中子輻射能夠產生4種鎄同位素:Es(α衰變半衰期為20.03天,自發裂變半衰期為7×10年)、Es(β衰變半衰期為38.5小時)、Es(α衰變半衰期為276天)及Es(β衰變半衰期為24天)。另一種合成方式是以氮離子或氧離子高強度撞擊鈾-238。
鎄-247(半衰期為4.55分鐘)是以碳離子撞擊鎇-241,或以氮離子撞擊鈾-238產生的。後者在1967年於俄羅斯杜布納進行,參與的科學家因此獲得了列寧共青團獎。
同位素Es是以氘離子撞擊Cf產生的。它主要以放射電子的形式進行衰變成為Cf,半衰期為25 ± 5分鐘;它也會進行能量為6.87 MeV的α衰變,釋放的電子數大約是α粒子數的400倍。
鎄-253是通過對0.1至0.2毫克的Cf目標進行熱中子照射產生的,中子通量為每秒每平方厘米2至5×10顆中子,照射時長為500至900個小時:
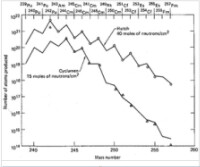
核試驗中超鈾元素產量的估值
由於相信在局限空間內的核爆可能會增加產生重元素的可能性,因此內華達試驗基地(現內華達國家安全區)又在1960年代進行地底核試驗,並採集數據。除了一般的鈾之外,核彈還裝有鎇和釷與鈾的混合物,以及鈈與鎿的混合物。試驗結果產量偏少,因為裝載的重元素提高了裂變率,並導致較重同位素的流失。對產物的提取分離非常困難,因為原子塵分佈在地下300至600米處熔化及汽化了的岩石中,而到如此的深度鑽地取樣又缺乏效率。
在1962至1969年間進行的9次地底核試驗中,最後一次的規模最大,而其超鈾元素產量也最高。在產量與原子質量數的關係圖(左圖)中,質量較低並擁有奇數質量數的同位素有較低的產量,因而在圖中產生鋸齒形的曲線。這是因為擁有奇數核子的同位素有較高的裂變率。研究中最大的問題在於採集爆炸后散落在各處的輻射落塵。載有濾紙的飛機只吸附到總量的4×10,而在埃內韋塔克環礁處所採集到的量也只增加了兩個數量級。在“Hutch”核試驗60天後提取的500公斤岩石當中也只有總量的10。這500公斤岩石,相比在爆炸7天後取得的0.4公斤石塊,其含超鈾元素的量只不過高出30倍。這證明超鈾元素的量與收集的岩石重量是不成正比的。為了加快樣本採集的速度,人們在核試驗之前就在爆炸原點鑽出了若干個豎井,這樣爆炸就會把足夠的樣本從中心通過豎井帶到地表,方便採樣。該方法在“Anacostia”和“Kennebec”核試驗中得到嘗試,並立即為研究提供了數百公斤的物質,但是其中錒系元素的濃度比通過鑽地取得的樣本的少三倍。這種方法雖然能夠有效幫助研究存留時間短的同位素,但卻無法提高整體錒系元素的產量。
儘管這一系列核試驗沒有再產生新的元素(除鎄和鐨外),而所取得的超鈾元素量也不如理想,但是其總體產生的稀有重同位素的量卻仍然比此前實驗室中能夠合成的要多。在“Hutch”核試驗中取得的包括大量稀有的Cm同位素,這是很難從Cm產生的:Cm的半衰期(64分鐘)相對需數個月時間的反應爐輻射來說太短,但對於核爆炸時間段來說就很長了。
鎄的同位素質量數被認為是從243~256的15種核素。最長壽命的核素252Es,半衰期為1.29年。這些核素是通過用氦離子(α粒子)轟擊錇(Bk)、用重離子轟擊適當的目標元素、用中子轟擊在原子反應堆內的239Pu等方法製取的。鎄是在鋦以後採用對錒系元素能有效分離的陽離子交換樹脂的圓柱色層法來分離的。
洗提過程:利用色離法分離Fm(100)、Es(99)、Cf、Bk、Cm及Am。

洗提過程:利用色離法分離
要在衰變產物中把三價的錒系元素從鑭系元素中分離出來,可以使用正離子交換樹脂柱,並注入含有90%水及10%乙醇的氫氯酸飽和溶液,作為洗提劑。其後一般使用負離子交換層析法,所用的洗提劑是濃度為6 M的氫氯酸。最後再以經銨鹽處理過的正離子交換樹脂柱(Dowex-50交換柱)來分離含有99、100及101號元素的分析層。根據洗提位置隨時間的變化,就可以辨認這幾個元素,可用的洗提劑包括α-羥基異丁酸溶液(α-HIB)。
對三價錒系元素的分離也可以通過溶劑萃取層析法進行,使用二(2-乙基己基)磷酸酯(簡稱HDEHP)作為靜止的有機相態,並使用硝酸作為流動的水溶相態。錒系元素的洗提順序與使用正離子交換樹脂柱時的順序相反。以這種方法分離出來的鎄不含有機絡化劑,而使用樹脂柱分離的鎄則會含有機絡化劑。
鎄是一種高活性元素,因此要從鎄化合物中提取純鎄金屬,須要使用強還原劑。其中一種方法是使用鋰來還原三氟化鎄:
● EsF3 + 3 Li → Es + 3 LiF
但是,由於熔點很低,而且其輻射也會迅速破壞其自身結構,所以鎄的蒸氣壓比氟化鋰還要高。這大大降低了這條反應的效率。早期的製備程序中曾嘗試用過這種方法,但研究人員很快就轉用鑭金屬來還原三氧化二鎄:
● Es2O3 + La → 2 Es + La2O3
氧化物:三氧化二鎄(Es2O3)呈無色立方晶體,可通過燃燒硝酸鎄(III)燃燒製成。
鎄的鹵化物具有+2及+3氧化態。EsF3、EsCl3、EsBr3、EsI3均已製得。
鎄的二價鹵化物不可以通過H2還原EsX3(X=F,Cl,Br,I)製得。
此外,鎄的化合物還有EsOCl、EsOBr及EsOI。
| 某些鎄化合物的晶體結構與晶格常數 | ||||||||
| [顯示]化合物 | 顏色 | 對稱性 | 空間群 | 編號 | 皮爾遜符號 | a(pm) | b(pm) | c(pm) |
|---|
三氧化二鎄(Es2O3)呈無色立方晶體,可通過燃燒硝酸鎄(III)燃燒製成。其首次被研究時的量只有數微克,晶體大小約為30納米。該氧化物還有其他兩種相態,結構分別屬於單斜晶系及六方晶系。Es2O3形成時的相態取決於其製備方式,還沒有相關的相態圖。在鎄的自我輻射及加熱下,三種相態會自發互相轉變。其六方晶系的相態與三氧化二鑭同型:Es離子被O離子以六配位的形式包圍。
在黑暗中發光的三碘化鎄
鎄的鹵化物具有+2及+3氧化態。從鎄的氟化物到碘化物,+3態最穩定的。
將氟離子注入三氯化鎄溶液,可以沉澱出三氟化鎄(EsF3)。另一種製備方法是在1至2個大氣壓及300至400 °C溫度下,讓三氧化二鎄與三氟化氯(ClF3)或與氟氣(F2)進行反應。EsF3的晶體結構屬於六方晶系,與三氟化鐦(CfF3)同型,其中的Es離子被氟離子以八面體八配位的形式包圍。
三氯化鎄(EsCl3)的製備方式是在約500 °C的乾氯化氫氣體中對三氧化二鎄進行退火20分鐘。在溫度降到大約425 °C 時,它就會開始結晶成一種橙色的固體。其晶體結構屬於六方晶系,與三氯化鈾同型,其中的鎄原子被氯原子以三帽三角菱柱九配位的形式包圍。三溴化鎄(EsBr3)是一種淺黃色固體,晶體結構屬於單斜晶系,與三氯化鋁同型,其中的鎄原子被溴原子以八面體六配位的形式包圍。
鎄的二價化合物可以通過用氫對其三價鹵化物進行還原而取得:
● 2 EsX3 + H2 → 2 EsX2 + 2 HX, X = F, Cl, Br, I
人們已製成了二氯化鎄(EsCl2)、二溴化鎄(EsBr2)、及二碘化鎄(EsI2),並對各個分別進行了光吸收特性的判定。沒有有關其結構的資料。
已知的鹵氧化物包括EsOCl、EsOBr及EsOI。其製成方式是將三鹵化物置於水和相應鹵化氫的混合氣體中,使其進行反應。例如,EsCl3 + H2O/HCl可產生EsOCl。
鎄的高放射性有用於放射性療法的潛力。科學家曾合成鎄的有機絡合物,從而將鎄原子帶到身體中指定的器官里。曾經有實驗把檸檬酸鎄(以及鐨化合物)注射到狗的體內。Es也被加入到β-二酮螯合物中,因為在紫外線照射下,鑭系元素的β-二酮螯合物在所有金屬有機化合物中擁有最強的冷發光效應。當製備鎄絡合物時,要用Gd把Es稀釋1000倍。這樣可以降低化合物被自身輻射破壞的程度,使化合物能夠在實驗所需的20分鐘內不至於瓦解。Es發光的強度太弱,因此未能被探測到。這是因為化合物中各部分的相對能量不理想,所以螯合物框架不能有效地把能量傳遞到Es離子中。在換成鎇、錇及鐨元素后,實驗有相同的結果。
Es離子的發光效應卻在無機氫氯酸溶液及含有二(2-乙基己基)正磷酸的無機溶液中被觀測到。波長峰值位於1064納米(半值寬度為100納米),可經由綠光照射來激發(約495納米波長)。發光持續數微秒,量子產額低於0.1%。Es的非輻射衰變率比鑭系元素的高,而這是由於Es的f軌道電子與內層電子間具有較強的相互作用。

愛因斯坦
1952年11月1日,美國在太平洋中的安尼維托克島(Eniwetok)上空試驗爆炸了一顆氫彈,在從爆炸地點仔細地收集了幾百公斤土壤中發現99號元素的同位素。
在1955年8月,在瑞士日內瓦召開的和平利用原子能國際科學技術會議中,根據人工合成這個新元素者們的建議,將99號元素命名為 einsteninium,以紀念20世紀中在原子和原子核科學中作出卓越貢獻的著名物理學家愛因斯坦。99號元素符號定為Es,在1957年國際純粹和應用化學聯合會的無機化學命名委員會在巴黎集會時改為Es。命名是在兩位物理學家ES,CS逝世之前提出的,但在其逝世后才被公布。
鎄在1952年12月由阿伯特·吉奧索等人於伯克利加州大學連同阿貢國家實驗室和洛斯阿拉莫斯國家實驗室合作發現。含有鎄的樣本采自“常春藤麥克”核試驗的輻射落塵。該核試驗於1952年11月1日在太平洋埃內韋塔克環礁上進行,是首次成功引爆的氫彈。對爆炸落塵的初步檢驗發現了一種新的鈈同位素( 244
94Pu),而這隻能通過鈾-238吸收6顆中子,再進行兩次β衰變才會形成。
當時一般認為,重原子核多次吸收中子是一件較罕見的現象,但24494Pu的形成意味著鈾原子核可能會捕獲更多的中子,從而產生比鐦更重的元素。
飛機搭載濾紙飛過爆炸殘餘的雲,濾紙再交由吉奧索等人進行分析(24494Pu也是用同一種方法發現的)。在核試驗進行地點埃內韋塔克環礁處受污染的珊瑚礁也被送到美國進行處理及分析,從中又提取了更多放射性物質。疑似新元素的分離是在微酸性(pH≈ 3.5)的檸檬酸/銨緩衝溶液中利用離子交換法在高溫下進行的。最後得出的鎄元素只有不到200個原子。不過,通過發現Es的特徵性α衰變能量(6.6 MeV),還是能夠探測到鎄的存在。該同位素是在鈾-238原子核捕獲了15顆中子,再經過7次β衰變后形成的,半衰期為20.5天。之所以能夠有這樣多次的中子捕獲,是因為核爆時所產生的高中子通量,使新產生的同位素能夠在衰變為較輕的元素之前吸收大量的中子。中子捕獲最初只會提高該核素的質量數(中子數加質子數),而不會提高其原子序(質子數);之後的β衰變再依序增加原子序:
某些U更能夠另外再吸收兩顆中子(一共17顆),形成Es,以及Fm。鐨(Fm)是在本次核試驗中發現的另一種新元素。由於正值冷戰時期,因此這些新元素的發現被美國軍方列為機密,直到1955年才被公布。這樣的快速多次中子捕獲使R-過程有了所需的實驗驗證。R-過程是一種多次中子捕獲的過程,能夠解釋某些重元素(鎳以上元素)是如何在超新星爆炸中合成的,這是宇宙中許多穩定元素的來源。
同時,位於伯克利及阿貢的實驗室利用氮-14和鈾-238之間的核反應以及對鈈和鐦進行強烈的中子輻射,也產生了鎄(和鐨)的一些同位素:
研究結果在1954年發布。報告中附有聲明,註明此前已有過對這些元素進行的研究。伯克利的研究團隊也發布了有關鎄和鐨化學屬性的研究結果。有關“常春藤麥克”核彈的研究在1955年解密。
與美國團隊競爭的,有位於瑞典斯德哥爾摩的諾貝爾物理研究所。1953年末至1954年初,該團隊以氧原子核撞擊鈾原子核,成功合成了較輕的一些鐨同位素,如Fm。這些結果也在1954年發布。但是,由於發布日期較早,所以人們一般還是承認伯克利團隊最先發現鎄元素。該團隊因此擁有對該元素的命名權。他們決定將第99號元素命名為Einsteinium,以紀念逝世不久的阿爾伯特·愛因斯坦(Albert Einstein,1955年4月18日逝);並將第100號元素命名為Fermium,以紀念另一位逝世不久的物理學家恩里科·費米(Enrico Fermi,1954年11月28日逝)。1955年8月8日至20日於第一屆日內瓦原子會議(Geneva Atomic Conference)上,阿伯特·吉奧索首次宣布發現這些新元素。鎄的最初符號為“E”,后改為“Es”。
鎄除了在基礎科學研究中用於製造更高的超鈾元素及超錒系元素之外,暫無其他應用。
1955年,勞倫斯伯克利國家實驗室用回旋加速器對約10個Es原子進行輻射,從而製造出鍆。所用的反應Es(α,n)Md產生了17個鍆原子(原子序為101)。
稀有的鎄-254同位素常被用於製造超重元素,因為它質量高,半衰期較長(270天),每次可取得的量也很高(數微克)。故此,在1985年,位於美國加州伯克利的superHILAC直線加速器使用了鎄-254來合成Uue(119號元素)。他們以鈣-48離子撞擊鎄-254目標體,但沒有探測到任何Uue原子。這為反應截面設下了300納靶恩的上限。
鎄-254曾用於校準勘測者5號月球登陸器上的化學分析光譜儀(見α-散射表面分析儀)。由於該同位素的質量很高,因此月表上輕元素與鎄-254同位素在分析儀上的信號重疊會大大減少。