元素電勢圖
元素電勢圖
元素電勢圖,大多數非金屬元素和過渡元素可以存在幾種氧化態,各氧化態之間都有相應的標準電極電勢,拉提默(Latimer)提出將它們的標準電極電勢以圖解方式表示,這種圖稱為元素電極電勢圖,或拉提默圖。比較簡單的元素電極電勢圖是把同一種元素的各種氧化態按照高低順序排成橫列。
關於氧化態的高低順序有兩種書寫方式:一種是從左至右,氧化態由高到低排列(氧化型在左邊,還原型在右邊);另一種是從左到右,氧化態由低到高排列。在兩種氧化態之間若構成一個電對,就用一條直線把它們連接起來,並在上方標出這個電對所對應的標準電極電勢。書寫某一元素的元素電勢圖時,既可以將全部氧化態標出,也可以根據需要列出其中的一部分。
元素電勢圖簡明、直觀地表明了元素各電對的標準電極電勢,對於討論元素各氧化值物種的氧化還原性和穩定性非常重要和方便。
判斷是否能發生岐化
對某一元素,其不同氧化數的穩定性主要取決於相鄰電對的標準電極電勢值。若相鄰電對的值符合,則處於中間的個體必定是不穩定態,可發生歧化反應,其產物是兩相鄰的物質。
這是很明顯的,如將兩相鄰電對組成電池,則中間物種到右邊物種的電對的還原半反應為電池正極反應,而到左邊物種的反應則為負極反應。電池的電動勢為,若,,表示電池反應可自發進行,即中間物種可發生歧化反應。
若相反,,則兩邊的個體不穩定,可發生逆歧化反應,兩頭的個體是反應物,產物是中間的那個個體。
求未知電對的電極電勢
利用Gibbs函數變化的加合性,可以從幾個相鄰電對的已知電極電勢求算任一未知的電對的電極電勢。
典型例子如下圖所示:

元素電勢圖
根據某一電對的電極電勢越大,則其氧化型的氧化能力越強,相應的還原型的還原性越弱的原理。由下列電勢圖:
元素電勢圖
在生產及科學研究中,常常要求在系統中只能允許某元素的某指定氧化數個體穩定存在於溶液,這時,可以通過選擇某一合理的氧化劑或還原劑來達到這一目的。
計算歧化反應和或歧化反應的限度
歧化反應或歧化反應進行的限度可以由反應的平衡常數得到判斷。
如,根據鹼性介質中氯元素的電勢圖:
元素電勢圖
根據可算出反應的平衡常數
而對於的另一歧化反應:
說明后一個歧化反應的趨勢更大。
求歧化反應的pH值
下面是溴元素在酸性介質中的電勢圖:
元素電勢圖
對氧化還原的產物作分析判斷
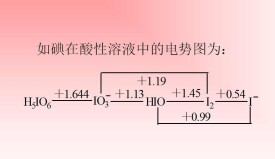
例如,由下列電勢圖判斷與I發生氧化還原反應的產物:
元素電勢圖
(1) 當的量很少,過量時,先將氧化為,再將繼續氧化,最終產物是;
(2) 當過量,的量不足時,將部分氧化為,生成的與足量的生成離子;
(3) 當控制用量 時,產物為純粹的I。