吉布斯相律
關於多相平衡的基本規律
吉布斯根據熱力學有關內能的原理,提出了“自由能”和“化學勢”在化學反應中起著動力作用的現代概念,奠定了化學平衡的理論基礎;而其中關於多相平衡的基本規律,即為“吉布斯相律(thephaserule),是適用於多相平衡的普適性的理論:若多相體系中具有C種獨立成分,其物相的數目p和自由度F之間的關係恆定。
約西亞·威拉德·吉布斯(Josiah Willard Gibbs)1839年2月11日生於美國康涅狄格州紐黑文城。在這裡有一所著名的大學—耶魯大學,吉布斯的父親就是這所大學的教授。1854一1858年吉布斯就學於該校,1863年在母校獲哲學博士學位並留校擔任助教(當時所謂“哲學博士”,指的就是自然科學博士)。1866一1868年先後留學法國和德國的高等學府,例如巴黎大學、柏林大學和海德堡大學,親耳聆聽了許多知名學者的演講。1869年回到耶魯大學繼續任教,1871年成為數學物理教授。他擔任此職一直到1903年在紐黑文逝世。
他在熱力學平衡與穩定性方面做了大量的研究工作並取得豐碩的成果,於1873-1878年間連續發表了3篇熱力學論文,奠定了熱力學理論體系的基礎。其中第三篇論文《論多相物質的平衡》是其最重要的成果。在這篇文章中,吉布斯提出了許多重要的熱力學概念,至今仍被廣泛使用。他完成了相律的推導。作為物理化學的重要基石之一,相律解決了化學反應系統平衡方面的眾多問題。他還提出了作為化學反應平衡判據的吉布斯自由能。吉布斯對於科學發展的另一大貢獻集中於統計力學方面,他於1902年出版了<《同熱力學合理基礎有特殊聯繫而發展起來的統計力學的基本原理》一書。在書中,他提出了系綜理論,導出了相密度守恆原理,實現了統計物理學從分子運動論到統計力學的重大飛躍。他被譽為富蘭克林以後美國最偉大的科學家,是世界科學史上的重要人物之一。
吉布斯相律
1873年吉布斯發表了《流體的熱力學的圖解方法》和《用曲面描述物質的熱力學性質的幾何方法》兩篇論文。他認為熵(S)也是最基本的熱力學概念,是同內能(U),體積(V),壓力(p),溫度(T)一樣的熱力學狀態函數。將熱力學第一定律和第二定律結合起來,他得到了熱力學基本方程。 1902年吉布斯出版了《同熱力學合理基礎有特殊聯繫而發展起來的統計力學的基本原理》,1889年之後吉布斯撰寫了一部關於統計力學的經典教科書《統計力學的基本原理》。
在這些論文中,他以詳盡的數學形式和嚴密的邏輯推理,探討了卡諾、焦耳、亥姆霍茲以及開爾文等人創立的熱力學原理,儘管這些原理是以研究熱機而引出的,但吉布斯卻將這些原理通過數學論述應用到化學反應及多相體系中。在這3篇論文中,最為有名的是第3篇(前兩篇可以說是第3篇的準備篇),這是一篇綜合性論文,先後分兩部分發表,對化學熱力學的數學基礎和理論基礎做出了開拓性的巨大貢獻,對多相平衡的理論研究有著極為豐富的思想內容。
吉布斯根據熱力學有關內能的原理,提出了“自由能”和“化學勢”在化學反應中起著動力作用的現代概念,奠定了化學平衡的理論基礎;而《同熱力學合理基礎有特殊聯繫而發展起來的統計力學的基本原理》論文中關於多相平衡的基本規律,即我們通常說的“吉布斯相律(,則是最為有名的普適性的理論發現:若多相體系中具有C種獨立成分,其物相的數目p和自由度F之間的關係為
當自由度F為零時的狀態即為平衡狀態。
在物理化學,吉布斯相律說明了在特定相態下,系統的自由度跟其他變數的關係。
吉布斯相律是相圖的基本原理,它指出:
其各個字母表示的含義分別為:
F:自由度
C:系統的組元數(例如化合物的數目)
P:在該點的相態數目
n:外界因素,多數取n=2,代表壓力和溫度;對於熔點極高的固體,蒸汽壓的影響非常小,可取n=1。
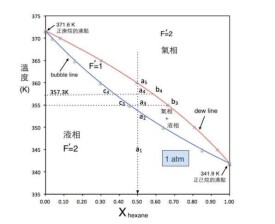
以水為例子,只有一種化合物,C=1。在三相點,P=3。F=1-3+2=0,所以溫度和壓力都固定。
當兩種態處於平衡,P=2,對應一個特定壓力,便恰好有一個熔點,即有一個自由度。吉布斯相律的預言正確:F=1-2+2=1。
吉布斯相律廣泛適用於多相平衡體系,若兩相平衡時,壓強不相等,則,吉布斯相律不適用。如滲透平衡。
吉布斯相律在提出之際並沒有實驗證明,僅是以抽象的數學論述形式,通過大量公式推導出來的理論發現。在生產實踐中開發相律的應用,並通過各種多相體系的科學研究找到有關相律應用的細節。這中間應當著重提到的是荷蘭物理化學家羅澤布姆的傑出工作,他把相律的實驗證明一與生產應用結合起來進行,為相律的發掘和推廣做出了巨大貢獻。
羅澤布姆受到范德瓦爾斯的指點,將相律應用於自己正從事的鹽水體系的研究工作,證明了相律與實驗結果完全一致。此後他又做了大量的和完整的實驗,對相律的各項參數實地測定。他還研究和解釋了將相律應用到許多非均相平衡體系的特例細節。
1887年他寫出了《復相化學平衡的各種形式》,採用了易於被化學家和冶金家理解的圖解法,即現在常見的“相圖”,對多相平衡體系加以描述,其中尤為重要的是進行了“固溶體”及“三相點”的研究,為後來研製合金及發展冶金學、地礦學等奠定了基礎。
吉布斯的“相律”對於多相體系是具有高度概括性的普適規律,雖然是抽象的,但卻是最本質的熱力學關係。在“相律”提出前後的一個時期內,曾有一些學者甚至是一些著名學者對相平衡間題獨立地作過研究,也得出一些規律,如早期的拉烏爾定律、亨利定律以及“相律”提出后但被埋沒的十幾年裡,比吉布斯出名得多的范霍夫和赫姆霍茲也曾不同程度地進行了研究工作。但這些人的工作都不過是“相律”的某些特例,可見吉布斯的優先權和詳盡性是毋容置疑的。
吉布斯相律雖然是研究物質聚集狀態之間的相態轉變及其平衡的規律,本質上是分子整體運動,應屬於分子物理學範疇;但是不同相態(物相)的分子之間的轉變,在一定意義上也可視為分子性質的質變,則屬於化學範疇。從相變過程在學科發展的歷史來看,它一直是化學家研究的世襲領地,因而成為邊緣學科—物理化學的一個基本內容。吉布斯相律的重要意義就在於推動了化學熱力學及整個物理化學的發展,也成為相關領域諸如冶金學和地質學等的重要理論工具。