滴定曲線
滴定曲線
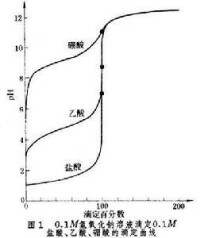
(見容量分析)過程中溶液性質。滴定曲線大致:①用濃度的對數函數表示(如圖1和圖2 中的pH和pZn,p即常用對數的負值)。由曲線等當點附近的變化,可以判定能否用指示劑確定終點,並據此選擇合適的指示劑;用正比於濃度的某種性質表示,滴定曲線是兩條直線,只是在等當點附近有些彎曲,由兩直線(或其延長線)的交點確定終點。儀器分析方法確定終點大多是這種情況。
滴定曲線計算
乙酸為弱酸(,Ka為離解常數),其 pH突躍範圍為7.7~9.7,只有兩個pH單位,且處於弱鹼性範圍內,應選用在鹼性範圍內變色的指示劑,如酚酞。如果用甲基橙為指示劑,在滴定終點時,被中和的乙酸大約只有30%,且變色緩慢。
如果用氫氧化鈉滴定更弱的硼酸(),在等當點附近,曲線很平,幾乎沒有突躍,就是說,加入大量氫氧化鈉溶液時pH的變化很小,即使找到在等當點變色的指示劑,顏色變化也必定是極其緩慢的,實際上將無法確定終點。
用酸滴定鹼的情況與鹼滴定酸類似,強酸滴定弱鹼的突躍範圍處於酸性範圍內,被滴定的鹼越弱,突躍越小,就難以用指示劑確定終點。為使突躍加大,一般選強酸、強鹼為滴定劑,而且濃度不能太小。
其他各類滴定曲線與酸鹼滴定曲線類似,只是表示的方法不同。在絡合滴定(見絡合滴定法)曲線(圖 2)中,以pΜ代替pH(Μ為金屬離子濃度);在沉澱滴定(見沉澱滴定法)曲線中,也以pΜ代替pH;在氧化還原滴定(見氧化還原滴定法)曲線中,則以電位E代替pH。

滴定曲線計算
