酸鹼中和滴定
酸鹼中和滴定
酸鹼中和滴定,是用已知物質量濃度的酸(或鹼)來測定未知物質的量濃度的鹼(或酸)的方法。實驗用中甲基橙、甲基紅、酚酞等做酸鹼指示劑來判斷是否完全中和。酸鹼中和滴定是最基本的分析化學實驗,也是普通高中化學的必修課程。
酸式滴定管
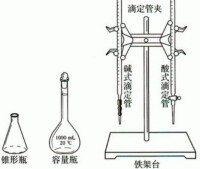
酸鹼滴定
滴定管夾
鐵架台
燒杯
一定規格的容量瓶(個別情況可能不需要)
用已知濃度的鹽酸來滴定未知濃度的NaOH溶液,以測定NaOH的物質的量濃度。
在開始試驗之前,先檢查滴定管是否漏水,用蒸餾水洗滌2~3次,再用標準液潤洗2~3次。然後,裝入標準溶液並記錄初讀數。取一定待測液於錐形瓶中。到此,準備工作完成。
把已知物質的量濃度的鹽酸注入事先已用該鹽酸溶液潤洗過的酸式滴定管,(至0刻度以上,把滴定管固定在滴定管夾上。輕輕轉動下面的活塞,使管的尖嘴部分充滿溶液且無氣泡。然後調整管內液面,使其保持在0或0以下的某一刻度,並記下準確讀數;把待測濃度的NaOH溶液注入事先已用該溶液潤洗過的鹼式滴定管,也把它固定在滴定管夾上。輕輕擠壓玻璃球,使管的尖嘴部分充滿溶液且無氣泡,然後調整管內液面,使其保持在“ 0”或“ 0”以下某一刻度)即最終低於或等於0,並記下準確讀數。
在管下放一潔凈的錐形瓶,從鹼式滴定管放出25.00 mL NaOH溶液,注入錐形瓶,加入 2滴甲基橙試液,溶液立即呈黃色。然後,把錐形瓶移到酸式滴定管下,左手調活塞逐滴加入已知物質的量濃度的鹽酸,同時右手按順時針方向不斷搖動錐形瓶,使溶液充分混合,眼睛注視錐形瓶內溶液顏色的變化。隨著鹽酸逐滴加入,錐形瓶里OH-濃度逐漸減小。最後,當看到加入1滴鹽酸時,溶液變成橙紅色,半分鐘后不再褪色。停止滴定,準確記下滴定管溶液液面的刻度,並準確求得滴定用去鹽酸的體積。為保證測定的準確性,上述滴定操作應重複二至三次,並求出滴定用去鹽酸體積的平均值。然後根據有關計量關係,計算出待測的NaOH溶液的物質的量濃度。
具體計量關係為 C(A)*V(A)=C(B)*V(B) ,其中A(Acid)為酸,B(Base)為鹼。
酸鹼指示劑的變色
人們在實踐中發現,有些有機染料在不同的酸鹼性溶液中能顯示不同的顏色。於是,人們就利用它們來確定溶液的pH。這種藉助其顏色變化來指示溶液pH的物質叫做酸鹼指示劑。
酸鹼指示劑一般是有機弱酸或有機弱鹼。它們的變色原理是由於其分子和電離出來的離子的結構不同,因此分子和離子的顏色也不同。在不同pH的溶液里,由於其分子濃度和離子濃度的比值不同,因此顯示出來的顏色也不同。例如,石蕊是一種有機弱酸,它是由各種地衣製得的一種藍色色素。
HIn在水中發生電離
如果用HIn代表石蕊分子,HIn在水中發生下列電離:HIn═In-+H+
如果在酸性溶液中,由於c(H+)增大,根據平衡移動原理可知,平衡將向逆反應方向移動,使c(HIn)增大,因此主要呈現紅色(酸色)。如果在鹼性溶液中,由於c(OH-)增大,OH-與HIn電離生成的H+結合生成更難電離的H2O:
使石蕊的電離平衡向正反應方向移動,於是c(In-)增大,因此主要呈現藍色(鹼色)。如果c(HIn)和c(In-)相等,則呈現紫色。
指示劑的顏色變化都是在一定的pH範圍內發生的,我們把指示劑發生顏色變化的pH範圍叫做指示劑的變色範圍。各種指示劑的變色範圍是由實驗測得的。
其他情況可用紫色石蕊試劑。
以反應生成物的酸鹼性為選擇標準。
指示劑 顏色變化 變色範圍(pH)
石 蕊(一般不用 因為範圍較廣且變色不夠明顯) 紅—藍 5.0~8.0
<5.0呈紅色
5.0~8.0呈紫色
>8.0呈藍色
甲基橙(一般用於酸式滴定) 紅—黃 3.1~4.4
<3.1呈紅色
3.1~4.4呈橙色
>4.4呈黃色
酚 酞 無—紅 8.2~10.0(注意:酚酞遇濃硫酸變橙色,一般用於鹼性滴定)
<8.2呈無色
8.2~10.0呈淺紅色
>10.0呈深紅色
⑴酚酞:鹼滴定酸時:顏色由無色恰好變為淺紅色
⑵甲基橙:酸滴定鹼時:顏色由黃恰好變為橙色。一般不選用石蕊。
酸鹼中和和滴定指示劑的選擇之二:為了減小方法誤差,使滴定終點和等當點重合,需要選擇適當的指示劑。強酸與弱鹼相互滴定時,應選用甲基橙。強鹼與弱酸相互滴定時,應選用酚酞。強酸與強鹼相互滴定時,既可選用甲基橙,也可選用酚酞作指示劑。注意,中和滴定不能用石蕊作指示劑。原因是石蕊的變色範圍(pH5.0~8.0)太寬,到達滴定終點時顏色變化不明顯,不易觀察。
酸鹼中和滴定指示劑的選擇之三:常用的指示劑多是弱酸或弱鹼,如石蕊;酚酞和甲基橙是比較複雜的有機酸。指示劑的分子和離子具有不同的顏色,酸或鹼溶液能影響指示劑的電離平衡,因此在酸或鹼溶液中指示劑會顯示不同的顏色。
⑴指示劑的變色範圍越窄越好,pH稍有變化,指示劑就能改變顏色。石蕊溶液由於變色範圍較寬,且在滴定終點時顏色的變化不易觀察,所以在中和滴定中不採用。
⑵溶液顏色的變化由淺到深容易觀察,而由深變淺則不易觀察。因此應選擇在滴定終點時使溶液顏色由淺變深的指示劑。強酸和強鹼中和時,儘管酚酞和甲基橙都可以用,但用酸滴定鹼時,甲基橙加在鹼里,達到滴定終點時,溶液顏色由黃變紅,易於觀察,故選擇甲基橙。用鹼滴定酸時,酚酞加在酸中,達到滴定終點時,溶液顏色由無色變為紅色,易於觀察,故選擇酚酞。
⑶強酸和弱鹼、強鹼和弱酸中和達到滴定終點時,前者溶液顯酸性,後者溶液顯鹼性,對後者應選擇鹼性變色指示劑(酚酞),對前者應選擇酸性變色指示劑(甲基橙)。
⑷為了使指示劑的變色不發生異常導致誤差,中和滴定時指示劑的用量不可過多,溫度不宜過高,強酸或強鹼的濃度不宜過大。
一 搖瓶時,應微動腕關節,使溶液向一個方向做圓周運動,但是勿使瓶口接觸滴定管,溶液也不得濺出。
二 滴定時左手不能離開旋塞讓液體自行流下。
三 注意觀察液滴落點周圍溶液顏色變化。開始時應邊搖邊滴,滴定速度可稍快(每秒3~4滴為宜),但是不要形成連續水流。接近終點時應改為加一滴,搖幾下,最後,毎加半滴,即搖動錐形瓶,直至溶液出現明顯的顏色變化,而且半分鐘內不褪色,準確到達終點為止。滴定時不要去看滴定管上方的體積,而不顧滴定反應的進行。加半滴溶液的方法如下:微微轉動活塞,使溶液懸掛在出口嘴上,形成半滴(有時還不到半滴),用錐形瓶內壁將其刮落。
四 每次滴定最好從“0.00”ML處開始(或者從0ML附近的某一段開始),這也可以固定使用滴定管的某一段,以減小體積誤差。
五 計算時應注意(酸式滴定時)
A、錐形瓶不用潤洗。
B、酸式滴定管沒用標準液潤濕,結果偏高。
六 數據處理
為減少實驗誤差,滴定時,要求重複試驗2~3次,求出所用標準溶液體積的平均值,然後在計算待測液的物質的量濃度。
影響滴定結果的因素
分析誤差時C待測取決於V標
⑴讀數:滴定前俯視或滴定後仰視(偏大)滴定前仰視或滴定后俯視(偏小)
⑵未用標準液潤洗滴定管(偏大);未用待測溶液潤洗滴定管(偏小)
⑶用待測液潤洗錐形瓶(偏大)
⑷滴定前標準液滴定管尖嘴有氣泡,滴定后尖嘴氣泡消失(偏大)
⑸不小心將標準液滴在錐形瓶的外面(偏大)
⑹指示劑(可當作弱酸)用量過多(偏大),當弱酸,說明是酚酞做指示劑,鹼滴定酸,相當於消耗更多的鹼,所以結果偏大。
指示劑(可當作弱鹼)用量過多(偏大),當弱鹼,說明是甲基橙做指示劑,酸滴定鹼,相當於消耗更多的酸,所以結果偏大。
⑺滴定過程中,錐形瓶振蕩太劇烈,有少量液滴濺出(偏小)
⑻開始時標準液在滴定管刻度線以上,未予調整(偏小)
⑼鹼式滴定管(量待測液用)或移液管內用蒸餾水洗凈后直接注入待測液(偏小)
⑽移液管吸取待測液后,懸空放入錐形瓶,少量待測液灑在外面(偏小)
⑾滴定到指示劑顏色剛變化,就是到了滴定終點(偏小)
⑿錐形瓶用蒸餾水沖洗后,不經乾燥便直接盛待測溶液(無影響)
⒀滴定接近終點時,有少量蒸餾水沖洗錐形瓶內壁(無影響)
(14)滴定時待測液滴定管尖嘴有氣泡,滴定后尖嘴氣泡消失(偏小)
(15)溶液顏色較淺時滴入酸液過快,停止滴定后反加一滴NaOH溶液顏色無變化(偏大)
