氧化鐵
紅棕色粉末
氧化鐵(ferric oxide),化學式Fe2O3。又稱燒褐鐵礦、燒赭土、鐵丹、鐵紅、紅粉、威尼斯紅(主要成分為氧化鐵)等。,易溶於強酸,中強酸,外觀為紅棕色粉末。其紅棕色粉末為一種低級顏料,工業上稱氧化鐵紅,用於油漆、油墨、橡膠等工業中,可作為催化劑,玻璃、寶石、金屬的拋光劑,可用作煉鐵原料。
2017年10月27日,世界衛生組織國際癌症研究機構公布的致癌物清單初步整理參考,氧化鐵在3類致癌物清單中。
中文別名:C.I.顏料紅101;透明鐵線;透明氧化鐵紅;;高導磁率氧化鐵;三氧化二鐵(藥用);鐵氧體用氧化鐵;氧化鐵水合物;氧化鐵,棕紅色;α-相氧化鐵;鐵紅粉;鐵丹;氧化鐵紅
英文名稱:Iron(Ⅲ) oxide
英文別名:C.I. 77491; C.I. Pigment Red 101; C.I. Pigment Red 101 and 102; C.I. Pigment Red 102; Ferric oxide; Iron (Ⅲ) Oxide Anhydrous; diiron trioxide; E 172; Iron (Ⅲ) oxide - calcined; Ironoxide anhydrous; Ironoxideredbrownpowder; Iron oxide - precipitated; Ferric oxide,medicinal; Ferric oxide for ferrite; Iron (Ⅲ) oxide, red; Hematite; IRON OXIDE RED; C.I.P. R.101; Iron (Ⅲ) oxide; diferric oxygen(-2) anion; oxo-(oxoferriooxy)iron; Iron Oxide
CAS號:1309-37-1;1317-60-8;1332-37-2
EINECS號:215-168-2;215-275-4;215-570-8
分子量:159.6882
氧化鐵是鐵鏽的主要成分。鐵鏽的主要成因是鐵金屬在雜質碳的存在下,與環境中的水分和氧氣反應,鐵金屬便會生鏽。用於油漆、油墨、橡膠等工業中,可做催化劑,玻璃、寶石、金屬的拋光劑,可用作煉鐵原料。氧化鐵最大的應用是作為顏料來使用。按顏色分為氧化鐵紅、氧化鐵黃、氧化鐵黑,氧化鐵棕由氧化鐵紅、氧化鐵黑(和氧化鐵黃)混合而成;氧化鐵橙是由氧化鐵紅和氧化鐵黃混合而成;氧化鐵綠是由藍色的酞菁蘭和氧化鐵黃混合而成。
穩定性:穩定,溶於鹽酸、稀硫酸生成鐵鹽。鐵單質在置換反應中生成亞鐵離子。
FeO+6HCl=2FeCl+3HO FeO+3HSO=Fe(SO)+3HO
儲運條件:存放於乾燥處,勿使受潮,避免高溫,並與酸鹼物隔離。按上述保管條件,未拆包裝的產品有效貯存期為三年。
溶解性:難溶於水,不與水反應。溶於酸,與酸反應。不與NaOH反應。
氧化性:高溫下被CO、H、Al、C、Si等還原。
FeO+2Al=點燃=2Fe+AlO
FeO+3CO=高溫=2Fe+3CO
2FeO+3C=高溫=4Fe+3CO↑
2FeO+3Si=高溫=4Fe+3SiO
⑴氧化鐵與酸反應生成鐵鹽和水。
例:FeO+6HCl=2FeCl+3HO
⑵鋁熱反應
鋁與氧化鐵混合后組成鋁熱劑,加熱後生成氧化鋁和鐵。
化學式:2Al+FeO=△=AlO+2Fe
⑶碳、一氧化碳還原性
氧化鐵可以與碳混合后加熱,鐵和二氧化碳提取出來。
化學式:3C+2FeO=高溫=4Fe+3CO↑
氧化鐵可以和一氧化碳混合后加熱,生成鐵和二氧化碳。
化學式:3CO+FeO=高溫=2Fe+3CO
性狀:紅棕色粉末
密度:5.24 g/cm³
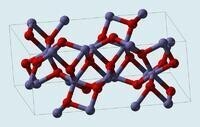
來源於維基百科
存在形式:礦物:赤鐵礦、赭石
α型晶胞結構:
磁性:在自然狀態下,氧化鐵屬於α型晶胞結構,並不具有磁性。但如果用四氧化三鐵經過特殊處理後會形成γ型晶胞結構,具有磁性,但並不穩定,易變為α型。
製備方法有濕法和干法。濕法製品結晶細小、顆粒柔軟、較易研磨,易於作顏料。干法製品結晶大、顆粒堅硬,適宜作磁性材料、拋光研磨材料。
FeSO+2NaOH=Fe(OH)+NaSO
4Fe(OH)+O+2HO=4Fe(OH)
4FeSO+4HO+O=2FeO↓+4HSO
Fe+HSO=FeSO+H↑
將一定量的5%硫酸亞鐵溶液迅速與過量氫氧化鈉溶液反應(要求鹼過量 0.04~0.08g/ml),在常溫下通入空氣,使之全部變為紅棕色的氫氧化鐵膠體溶液,作為沉積氧化鐵的晶核。以上述晶核為載體,以硫酸亞鐵為介質,通入空氣,在75~85℃,在金屬鐵存在下,硫酸亞鐵與空氣中氧氣作用生成氧化鐵(即鐵紅)沉積在晶核上,溶液中的硫酸根又與金屬鐵作用重新生成硫酸亞鐵,硫酸亞鐵再被空氣氧化成鐵紅繼續沉積,這樣循環至整個過程結束,生成紅色氧化鐵。
在空氣中灼燒亞鐵化合物或氫氧化鐵等可得氧化鐵。
4FeO+O 6FeO
在潮濕的空氣中,鋼鐵表面吸附了一層薄薄的水膜,這層水膜里含有少量的H 和OH ,還溶解了氧氣,結果在鋼鐵表面形成了一層電解質溶液,它跟鋼鐵里的鐵和少量的碳(因鋼鐵不純)恰好形成無數微小的原電池。在這些原電池裡,鐵是負極,碳是正極。鐵失去電子而被氧化:
負極:2Fe 4e =2Fe
正極:2HO+O+4e =4OH
電化學腐蝕是造成鋼鐵腐蝕的主要原因。
在此之後繼續反應:
Fe+2OH =Fe(OH)
4Fe(OH)+O+2HO=4Fe(OH)
2Fe(OH)+nHO=FeO·nHO+3HO
在初中的化學里,可用鹽酸(HCl)來除鐵鏽。
方程式為:FeO+6HCl=2FeCl+3HO
硝酸與鐵屑反應生成硝酸亞鐵,經冷卻結晶、脫水乾燥,經研磨后在600~700℃煅燒8~10h,在經水洗、乾燥、粉碎製得氧化鐵紅產品。也可以氧化鐵黃為原料,經600~700℃煅燒製得氧化鐵紅。4Fe(NO)→2FeO+12NO↑+3O↑ FeO·nHO→FeO+nHO;先製得透明氧化鐵黃(製法參見透明氧化鐵黃),經煅燒脫水,製得透明氧化鐵紅。其2α-FeOOH 2α-FeSO+HO。
採用中和沉澱法。先製得氧化鐵黑,再高溫灼燒製得透明氧化鐵線。將0.5mol/L濃度的FeCl·6HO溶液加熱沸騰水解至紅棕色膠粒出現為止(溶液1)。取與溶液1等體積的0.25mol/L的FeCl溶液(由金屬鐵與鹽酸作用製得),用稀氨水調至白色沉澱不再消失為止(溶液2)。將溶液1和溶液2合併,攪拌,並加入適量的羥基羧酸絡合劑和緩衝劑,維持恆溫80℃。隨反應的進行,不斷有黑色FeO生成。反應結束,將FeO結晶轉移至pH8、含有為FeO質量比為10%~20%的油酸鈉溶液中進行表面處理,攪拌懸濁液,恆溫80℃,0.5h后將懸濁液用稀鹽酸(1:3)調pH=6~6.5,將FeO油酸吸附包覆物(黑色絮凝體)抽濾,熱水攪洗數次,50~60℃真空烘乾,製得疏鬆的粉體FeO。將上述油酸包覆的FeO慢速升溫至550~600℃焙燒0.5h,得到均勻分散的透明鐵紅α-FeO微粒子。
雲母赤鐵礦法:雲母赤鐵礦石精選后,經濕球磨機磨成精礦粉,脫水,烘乾,冷卻,粉碎至325目,過篩,製成雲母氧化鐵。
硫酸亞鐵氧化法:將硫酸與鐵屑反應製得硫酸亞鐵,除砷及重金屬,經氧化而得。流程參見氧化鐵黃。
製備方法有濕法和干法。濕法製品結晶細小、顆粒柔軟、較易研磨,適宜作顏料。干法製品結晶大、顆粒堅硬,適宜作磁性材料、拋光研磨材料。濕法將一定量的5%硫酸亞鐵溶液迅速與過量燒鹼溶液反應(要求鹼過量0.04~0.08 g/ml),在常溫下通入空氣使之全部變成紅棕色的氫氧化鐵膠體溶液,在金屬鐵存在的條件下,硫酸亞鐵與空氣中氧作用,生成氧化鐵(即鐵紅)沉積在晶核上,溶液中的硫酸根又與金屬鐵作用,重新生成硫酸亞鐵,硫酸亞鐵再被空氣氧化成鐵紅繼續沉積,如此循環到整個過程結束,生成氧化鐵紅。其干法硝酸與鐵片反應生成硝酸亞鐵,經冷卻結晶,脫水乾燥,經研磨后在600~700℃煅燒8~10h,再經水洗、乾燥、粉碎製得氧化鐵紅產品。也可以氧化鐵黃為原料,經600~700℃煅燒製得氧化鐵紅。其4Fe(NO) 2FeO+12NO↑+3O↑FeO+n HO FeO+nHO
磁性材料
磁性氧化鐵粒子由於其特殊的超順磁性,在巨磁電阻、磁性液體和磁記錄、軟磁、永磁、磁致冷、巨磁阻抗材料以及磁光器件、磁探測器等方面具有廣闊的應用前景。錄像磁帶一般使用針狀鐵或氧化鐵磁性超微粒,而納米氧化鐵是新型磁記錄材料。軟磁鐵氧體在無線電通訊、廣播電視、自動控制、宇宙航行、雷達導航、測量儀錶、計算機、印刷、家用電器以及生物醫學領域均得到了廣泛應用。
氧化鐵顏料領域
氧化鐵作為顏料廣泛用於高檔汽車塗料、建築塗料、防腐塗料、粉末塗料,是較好的環保塗料,全世界氧化鐵系顏料的年用量超過100萬t,僅次於鈦白,居無機顏料的第二位。用氧化鐵作為顏料,既保持了一般無機顏料良好的耐熱性、耐候性和吸收紫外線等優點,又能很好地分散在油性載體中,用它調製的塗料或油墨具有令人滿意的透明度。利用具有半導體特性的氧化鐵等做成塗料,由於具有較高的導電特性,能起到靜電屏蔽作用。
氧化鐵是玻璃生產中常用的著色劑。氧化鐵著色的玻璃既能吸收紫外線又吸收紅外線,因而廣泛用於製造吸熱玻璃、太陽鏡玻璃、工業防護眼鏡玻璃以及軍用防紅外塗料。同時具有價格低廉,吸收熱線以及紫外線的功能。
此外,國外也大量使用氧化鐵顏料作木材塗裝的著色劑及保護劑。使用透明氧化鐵顏料代替傳統顏料可保留木材清晰的木紋,而本身很高的耐光性又使傢具顏色經久不變。陽光中的紫外線能使木材的木質素分解而破壞細胞結構,導致木材老化,而納米氧化鐵顏料由於顆粒細小、分佈均勻,不會散射光線,且吸收紫外線輻射,因而可起到保護木材的作用。
氧化鐵催化領域
α-Fe2O3粉體粒子具有巨大的比表面,表面效應顯著,是一種很好的催化劑。由於氧化鐵粒子細小,表面所佔的體積百分數大,表面的鍵態和電子態與顆粒內部不同,表面原子配位不同等導致表面的活性位增加。用納米 α-Fe2O3粒子製成的催化劑的活性、選擇性都高於普通的催化劑,且壽命長、易操作。納米 α-Fe2O3已直接用作高分子聚合物氧化、還原及合成的催化劑,當其用於石油提煉時可使裂解速度提高 1~5 倍,以其作為固體燃燒劑的催化劑可使燃燒速度較普通燃燒劑的燃燒速度提高 1~10 倍,這對製造高性能火箭及導彈十分有利。
氧化鐵生物醫學及其它領域
納米氧化鐵在藥用膠囊、藥物合成、生物醫學技術等領域發揮著重要的作用。α-Fe2O3除了在磁性材料、顏料、催化領域、生物醫學領域得到應用外,在其它領域中也有廣泛的應用前景。例如,納米級氧化鐵對 Cr(Ⅵ)具有較好的吸附作用,吸附效率高,吸附時間短,而且可以回收並重複使用,對於處理環境污水中的Cr(Ⅵ),具有一定的應用價值;用納米 α-Fe2O3製成的氣敏材料,具有響應速度快、選擇性強、靈敏度高、穩定性好等特點;在製備透明氧化鐵時,若嚴格控制砷和重金屬的含量,則可用於食品、化妝品等行業;由於透明氧化鐵具有透明著色、耐酸耐鹼而又無毒的特性,也可作為罐頭蓋內壁的塗料,在美國有著大量的應用。
