氣體摩爾體積
單位物質的量的氣體所佔的體積
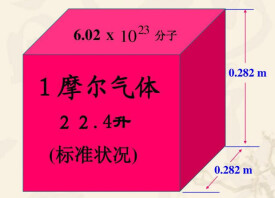
單位物質的量的氣體所佔的體積,這個體積叫做該氣體摩爾體積,單位是L/mol(升/摩爾) ,在標準狀況下(STP,0℃,101.33kPa)1摩爾任何理想氣體所佔的體積都約為22.4升,氣體摩爾體積為22.4 L/mol。在25℃,1.01×10^5Pa時氣體摩爾體積約為24.5L/mol。
氣體摩爾體積
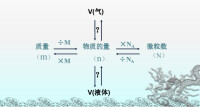
摩爾體積,其中V為物質體積;n為物質的量(單位mol)
氣體摩爾體積:理想中一摩爾氣體在標準大氣壓下的體積為22.4L,較精確的是:Vm=22.41410L/mol。
單位物質的量的氣體所佔的體積叫做氣體摩爾體積,相同氣體摩爾體積的氣體其含有的粒子數也相同。氣體摩爾體積不是固定不變的,它決定於氣體所處的溫度和壓強,如在25 °C,101千帕時氣體摩爾體積為24.5升/摩爾。在外界條件相同的情況下,氣體的摩爾體積相同。
氣體摩爾體積Vm與T、P、n等之間關係:
1、同溫度、同壓強下,V相同,則n相同。
2、同溫度、同壓強下,
3、定義:在相同的溫度和壓強下,1mol任何氣體所佔的體積在數值上近似相等。人們將一定的溫度和壓強下,單位物質的量的氣體所佔的體積叫做氣體摩爾體積。

氣體摩爾體積
公式:
使用時應注意:
①必須是標準狀況(0℃,100kPa)。此時氣體摩爾體積約為22.4 L/mol。
②“任何理想氣體”既包括純凈物又包括氣體混合物。
③22.4升是個近似數值。
④單位是L/mol,而不是L。
⑤決定氣體摩爾體積大小的因素是氣體分子間的平均距離;而影響氣體分子質量間的平均距離的因素是溫度和壓強。
⑦氣體摩爾體積通常用Vm表示,計算公式n=V/Vm,Vm表示氣體摩爾體積,V表示體積,n表示物質的量。
⑧標況下,1mol的任何氣體的體積約是22.4 L,達到氣體摩爾體積的氣體物質的量一定為1mol。
(1)總結規律:①相同條件下,相同物質的量的不同物質所佔的體積:固體<液體<氣體[水除外]。②相同條件下,相同物質的量的氣體體積近似相等,而固體、液體卻不相等。
(2)決定物質體積大小的因素:①物質粒子數的多少;②物質粒子本身的大小;③物質粒子之間距離的大小。
(3)決定氣體體積大小的因素:氣體分子間平均距離比分子直徑大得多,因此,當氣體的物質的量(粒子數)一定時,決定氣體體積大小的主要因素是粒子間平均距離的大小。
(4)影響氣體分子間平均距離大小的因素:溫度和壓強。溫度越高,體積越大;壓強越大,體積越小。當溫度和壓強一定時,氣體分子間的平均距離大小几乎是一個定值,故粒子數一定時,其體積是一定值。
對1mol任何氣體所佔的體積都約是22.4 L的理解:
(1)標準狀況(簡稱 標況):指氣體在0℃、100 KPa下的狀態。溫度越高,體積越大;壓強越大,體積越小。故在非標況下,其值不一定就是“22.4 L”。但若同時增大壓強,升高溫度,或是降低壓強和溫度,1摩爾任何氣體所佔的體積有可能為22.4升。
(2)1mol氣體在非標準狀況下,其體積可能為22.4 L,也可能不為22.4 L。如在室溫(20℃,一個大氣壓)的情況下氣體的體積是24L。
(3)氣體分子間的平均距離比分子的直徑大得多,因而氣體體積主要決定於分子間的平均距離。在標準狀況下,不同氣體的分子間的平均距離幾乎是相等的,所以任何氣體在標準狀況下氣體摩爾體積都約是22.4 L/mol.
(4)此概念應注意:①氣態物質;②物質的量為1mol;③氣體狀態為0℃和100 KPa(標況);④22.4 L體積是近似值;⑤Vm的單位為L/mol和m^3/mol。
(5)適用對象:純凈氣體與混合氣體均可。
同溫同壓下體積相同的任何氣體都含有相同的分子數即阿伏加德羅定律。由此可見氣體的體積比在同溫同壓下必等於分子數比。由此可以導出同溫同壓下不同氣體間的關係:
(1)同溫同壓下,氣體的體積比等於物質的量比。 V1/V2=n1/n2
(2)同溫同體積下,氣體的壓強比等於物質的量比。 p1:p2=n1:n2
(3)同溫同壓下,氣體的摩爾質量比等於密度比。 M1:M2=ρ1:ρ2
(4)同溫同壓下,同體積的氣體質量比等於摩爾質量比。 m1:m2=M1:M2
(5)同溫同壓下,同質量氣體的體積比等於摩爾質量的反比。 V1:V2=M2:M1
此外還在運用時要結合物理中的同物質的量的氣體在同溫時,其體積與壓強成反比;氣體體積與熱力學溫度在同壓條件下成正比。(可參考理想氣體狀態方程理解:pV=nRT 其中p是壓強,V是體積,n是物質的量,R是氣體常數,T是熱力學溫度)
標準狀況下1mol氣體為22.4 L,即可導出其質量便是該氣體的摩爾質量。據此可求出未知化學式的氣體摩爾質量和相對分子質量,也可求出1L氣體的質量即氣體密度。反之也可由氣體密度求摩爾質量。同溫同壓下兩氣體的密度比叫氣體的相對密度,可據以由氣體的相對密度求氣體的摩爾質量,如某氣體對氫氣(H2)的相對密度為15,則其相對分子質量為30。常見的有:
(1)由標準狀況下氣體密度求相對分子質量;
(2)由相對密度求氣體的相對分子質量; .
(3)求混合氣體的平均相對分子質量:即混合氣體1mol時的質量數值。已知各組成氣體的體積分數及質量分數;
(4)由同溫同壓下氣體反應時的體積比求分子數比,進而推分子式;
(5)直接將氣體摩爾體積代入有關化學方程式進行計算;
(6)氣體反應物的體積比即分子數比可便於找出過量氣體。
阿伏加德羅定律及推論都可由理想氣體狀態方程及其變形推出(壓強、體積、絕對溫度、物質的量、氣體常數、密度)。由定律可導出:“一連比、三正比、二反比”的規律。
1.“一連比”:指在同溫同壓下,同體積的任何氣體的質量比等於摩爾質量(相對分子質量)之比,等於密度比。
2.“三正比”
(1)同溫同壓下,兩氣體的體積之比等於其物質的量之比,等於其分子數之比。
(2)同溫同體積下,兩氣體的壓強之比等於其物質的量之比,等於其分子數之比。
(3)同溫同壓下,兩氣體的密度之比等於其摩爾質量(相對分子質量)之比。
3.“二反比”
(1)同溫同壓同質量下,兩氣體的體積與其摩爾質量(相對分子質量)成反比。
(2)同溫同分子數(或等物質的量)時,兩氣體的壓強與其體積成反比。
固液的分子間的間隔很小,體積的大小是靠分子的數量來決定的。氣體不一樣,分子間的間隔很大,體積是靠每一個分子所佔的空間大小來決定的,這一空間遠遠大於單個分子的大小所以分子的大小,可以不計。
又因為每個分子所佔的空間大小近乎相同,所以就有了氣體摩爾體積的概念但液體和固體就沒有了。