化學方程式
化學方程式
化學方程式,也稱為化學反應方程式,是用化學式表示化學反應的式子。化學方程式反映的是客觀事實。用化學式(有機化學中有機物一般用結構簡式)來表示物質化學反應的式子,叫做化學方程式。
化學方程式不僅表明了反應物、生成物和反應條件。同時,化學計量數代表了各反應物、生成物物質的量關係,通過相對分子質量或相對原子質量還可以表示各物質之間的質量關係,即各物質之間的質量比。對於氣體反應物、生成物,還可以直接通過化學計量數得出體積比。
以受熱分解的化學方程式為例:
第一步:寫出反應物和生成物的化學式。
第二步:配平化學式。
第三步:註明反應條件和物態等。
第四步:檢查化學方程式是否正確。
1.熱化學方程式寫反應條件。一般的在等號上方標記Δ。配平係數大多不可以是可以是分數(相互之間可以約分除外)。
2.常溫常壓下可以進行的反應,不必寫條件;但是題目中的實驗若有特定的條件,一律標註該特定條件(如加熱)。
3.反應單一條件時,條件一律寫上面;有兩個或更多條件的,上面寫不下的寫在下面;既有催化劑又有其它反應條件時,一律把催化劑寫在上面。
4.是可逆反應的一律用雙向箭頭表示。
在專業領域的文獻中,不論無機、有機反應方程式中均使用箭頭號“→”來連接反應物和生成物。國外化學教科書、上海市中學化學二期課改教材(上海科學技術出版社2006年7月,姚子鵬主編)、2011-2012蘇教版化學書、上海高考的化學卷、理綜卷中也採用了箭頭號。但在多數省市的中學教學中,仍建議按照教材在書寫無機化學反應方程式時使用等號,以更好地表示反應中的“生成”與“質量守恆”含義。
2013年中學階段無機反應方程式一律用等號連接反應物和生成物,有機反應一律用箭頭來連接反應物和生成物,是可逆反應的一律用可逆符號表示。
1.氣體符號“↑”和沉澱符號“↓”是化學反應中生成物的狀態符號。只有生成物才能使用“↑”或“↓”符號,使用時寫在相應化學式的右邊。
2.當生成物在反應條件是氣態的,才用“↑”號,如:
但還必須同時注意兩點:
(1)若反應物中有一種或幾種氣態物質,則生成的氣態物質不再用“↑”號,如:
(2)不論反應物狀態如何,只要產物只有一種物質,且是氣體時也不用“↑”。
3.在溶液中進行的化學反應,有難溶物質或不溶物質生成時,用“↓”號表示。如:
4.若反應不是在溶液中進行的,就不存在沉澱析出現象,不能用“↓”號。如:
6.在複分解反應中,若生成物是微溶物時,應把它視為“沉澱”,標上“↓”。如:
7.必須以客觀事實為依據,即使是同一個化學反應,也必須要看具體情況。如硫化氫與二氧化硫氣體混合反應生成硫,不用沉澱符號,即:
當把二氧化硫通入到氫硫酸時,溶液中出現了黃色的渾濁現象,生成的單質硫應標上“↓”,即
又如向氯化銀懸濁液中滴加硫化鈉溶液,白色沉澱變成黑色,發生了沉澱的轉化,生成的硫化銀應標上“↓”,即:
熱化學方程式
加熱化學方程式需要標出每一個反應物、生成物的狀態,可分g(氣體)、l(液體)、s(固體)、aq(溶液)四大類。字母外需要打括弧,例如H2O(l)、Na2CO3(aq)、CaCO3(s)。
普通方程式則不用g、l、s、aq的標記。生成物方面,當反應物中不含氣體時,氣體生成物要用“↑”標記;只有在溶液中,反應物中不含固體時,難溶或固體生成物一律用“↓”標記。如電解池反應的化學方程式:
由於生成Cu吸附在電極上,故不寫“↓”。
水蒸氣
水蒸氣一般打箭頭,但偶有例外(碳酸氫銨受熱分解)。
反應物狀態的不同
反應物若以特殊狀態參加反應,例如濃硫酸、熔融氧化鋁,過量,少量,一律在相應的反應物后打括弧註明狀態
<1>反應物的濃度不同,產物不同
如:銅與濃硝酸反應的化學方程式:
銅與稀硝酸反應的化學方程式:
<2>反應物的量不同,產物不同
如:鎂與過量二氧化碳反應的化學方程式:
鎂與少量二氧化碳反應的化學方程式:
<3>反應物的物態不同,產物不同
如:電解氯化鈉溶液的化學方程式:
電解熔融氯化鈉的化學方程式:
要正確書寫物質的化學式,一是要熟練記憶元素符號,二是書寫化合物的化學式時,要熟練記憶常見元素和原子團的化合價,三是書寫化合物的化學式要符合各元素正負化合價的代數和為零的原則,四是掌握書寫化學式的一般方法。總起來說,這就是書寫化學式的要領。
化學式的一般寫法是:
(1)單質的化學式
除H2、O2、N2、F2、Cl2、Br2和I2七種單質為雙原子分子,O3為三原子分子,P4為四原子分子外,其餘單質(稀有氣體、金屬單質和非金屬固態單質等)都是以元素符號表示其化學式。
(2)化合物的化學式
書寫時一般規律是先讀後寫,後讀先寫;排好順序,寫好角號。一般將顯正價的元素或原子團寫在左邊,顯負價的元素或原子團寫在右邊。其書寫步驟是:定位、標價、交叉約簡和檢驗四步。
①定位:確定元素或原子團的順序。
②標價:正確地在各元素或原子團的上方標出化合價。
③交叉約簡:將化合價的絕對值交叉寫在對方元素或原子團的右下方,能約簡的要約為最簡約數。原子或原子團的個數為1時,通常1省去不寫。原子團在2個或2個以上時,應加上括弧。
④檢驗:當正價總數與負價總數之和為零時,化學式正確。
1.書寫化學方程式的步驟
以書寫碳在高溫時跟氧化鐵反應的化學方程式為例,歸納步驟如下:
①根據反應的事實(該反應生成鐵和二氧化碳氣體),在式子的左邊寫出反應物的化學式,在式子的右邊寫出生成物的化學式。反應物或生成物不止一種,就分別用加號把它們連接起來(反應物之間的“+”號表示“……跟……反應”,生成物之間的“+”號表示“……跟……”),並在式子左、右之間劃一條短線段。在這一步里,一定要注意把各種物質的化學式寫正確,否則,寫出的式子無意義!
②根據質量守恆定律,用配係數的方法,使左、右兩邊同一元素原子的個數相等(即配平),然後將短線段改為等號(等號表示“生成了……”)。應當注意,配平時只能選擇適當的係數,不能改變化學式。
③在等號或箭號上、下方註明反應條件,如點燃、電解、高溫、加熱(用“△”號表示)、催化劑等,同時,標明生成物中的氣體或沉澱產物的狀態。生成物是氣體的在其化學式的右邊加上“↑”號(反應物中如有氣體,則氣態生成物不再標“↑”符號);產物是沉澱的加“↓”號。
概而言之,在書寫化學方程式時,必須要符合化學反應的客觀規律,不能憑空臆造。書寫程序一般是:寫好化學式—係數要配平—中間聯等號—條件要注清—生成氣體或沉澱,要用箭號來標明。
要寫好化學方程式,還要熟練掌握和運用酸、鹼、鹽的溶解性表,金屬活動性順序和常見元素、原子團的化合價,以及書寫物質化學式的技能。
2.化學方程式書寫中常見錯誤簡析
一是亂套“公式”。一些同學書寫化學方程式時,雖然注意了不能憑空臆造化學式,但又沒有掌握典型記憶與類型推導相結合的方法,加之缺乏化學基礎知識,因而把記住的某個熟悉的化學方程式當作為一般公式去套用,犯了亂套“公式”的錯誤。
二是亂寫逆反應。產生此類錯誤的原因是,初中學生把化學方程式與數理方程式混為一談,隨意把化學方程式倒過來寫。我們知道,數理方程式可以移項,或將等號左右兩端反過來寫;而化學方程式與數理方程式是絕然不同的兩種概念。雖然有些化學反應是可逆的,但多數化學反應並非如此。至於有些反應,在相同或不相同的條件下,能夠向相反方向進行,也不一定是可逆反應,而是意義完全相反的反應類型。
三是亂標生成物的狀態和反應條件。
四是亂寫化學式。例如:
1.根據化學方程式的計算
化學方程式不僅表示什麼物質參加反應和反應後生成什麼物質,而且還表示反應物和生成物各物質間的質量比。根據化學方程式的計算就是依據反應物和生成物之間的質量比進行的。因此,已知反應物的質量可以算出生成物的質量;已知生成物的質量可以算出反應物的質量;已知一種參加反應的反應物的質量可以算出另一種參加反應的反應物的質量;已知一種生成物的質量可以算出另一種生成物的質量。
化學計算題是從“量”的方面來反映物質及其變化規律的。化學計算包括化學和數學兩個因素,其中化學知識是數學計算的基礎,數學又是化學計算的工具。根據化學方程式的計算,必須對有關的化學知識有清晰的理解,熟練掌握有關反應的化學方程式。如果化學方程式中的化學式寫錯了,或者沒有配平,化學計算必然會得出錯誤結果。
2.根據化學方程式計算的步驟
(1)根據題意設未知量。
(2)根據題意寫出正確的化學方程式。
(3)寫出有關物質的相對分子質量或相對分子質量和以及已知量和未知量。寫在化學方程式的相對應的化學式的下面。
(4)列比例式,求解。
(5)簡明的答題。
3.根據化學方程式計算的注意事項
(1)解題格式必須規範。
(2)根據化學方程式計算是以純凈物的質量進行計算,對於不純的反應物或不純的生成物必須折算成純凈物的質量,再進行計算。
(3)必須正確使用單位。
4.根據化學方程式計算時,常見的錯誤:
(1)不認真審題,答非所問。
(2)元素符號或化學式寫錯。
(3)化學方程式沒有配平。
(4)相對分子質量計算錯誤。
(5)單位使用錯誤。
(6)把不純物質當成純凈物進行計算。
A、找出原子個數較多,且在反應式兩邊各出現一次的原子,求它的最小公倍數。
B、推出各分子的係數。
例如:
第一步:CuSO4+NaOH—Cu(OH)2+Na2SO4
第二步:CuSO4+2NaOH—Cu(OH)2+Na2SO4(配平)
第三步:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4(註明生成物物態)
從化學式較複雜的一種生成物推算有關各反應物化學式的化學計量數和該生成物的化學計量數;根據求得的化學式的化學計量數,再找出其他化學式的化學計量數,直至配平。
例如:第一步H2O(g)+Fe---Fe3O4+H2
第二步4H2O(g)+3Fe---Fe3O4+H2
第三步4H2O(g)+3Fe=Fe3O4+4H2(反應條件:加熱)
看哪種元素在反應化學方程式左右兩邊出現次數最多;從該元素個數為奇數的化學式入手,將其配成偶數(即化學計量數為2);由它求得的化學計量數配平其他化學式的化學計量數,使兩邊原子個數相等。
例:配平
H2O(g)+Fe---Fe3O4+H2
第一步:配平氧原子
4H2O(g)+Fe---Fe3O4+H2
第二步:配平氫原子、鐵原子
4H2O(g)+3Fe---Fe3O4+4H2
第三步:配平后的化學方程式:
4H2O(g)+3Fe=Fe3O4+4H2(反應條件:加熱)
對於氧化還原反應,先觀察得出氧化劑失氧的數目,再觀察得出還原劑得氧的數目,然後配平
比如:3CO+Fe2O3=2Fe+3CO2
氧化劑氧化鐵反應前後失掉三個氧,還原劑一氧化碳反應前後得到一個氧,所以需要三個一氧化碳才能奪去氧化鐵中的氧,一氧化碳、二氧化碳配3,鐵配2
(1)適用範圍:適用於含碳、氫的化合物(或含碳、氫、氧的化合物)與氧氣的反應。
(2)步驟:在反應物或生成物中找出化學式比較複雜的一種物質,將其化學計量數定為1,以此化學式為基準,推求與其有關的化學式的化學計量數。
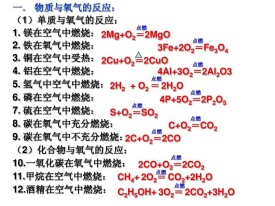
(1)單質與氧氣的反應:(化合反應)
1.鎂在氧氣中燃燒:
2.鐵在氧氣中燃燒:
3.銅在氧氣中受熱:
4.氫氣在氧氣中燃燒:
5.紅磷在氧氣中燃燒(研究空氣組成的實驗):
6.硫在氧氣中燃燒:
7.碳在氧氣中充分燃燒:
8.碳在氧氣中不充分燃燒:
(2)氧氣與化合物的反應:
10.一氧化碳在氧氣中燃燒:
11.甲烷在氧氣中燃燒:
12.酒精在氧氣中燃燒:
(3)氧氣的來源:
13.拉瓦錫研究空氣的成分實驗
14.加熱高錳酸鉀:(實驗室制氧氣原理1)
15.加熱氯酸鉀和二氧化錳混合物:(實驗室制氧氣原理2)
16.過氧化氫在二氧化錳作催化劑條件下分解反應:(實驗室制氧氣原理3)
植物的光合作用:6CO2+6H2O==光/葉綠素==6O2+C6H12O6
17.水在直流電的作用下分解(研究水的組成實驗):
18.生石灰溶於水:
(1)碳的化學性質
19.碳在氧氣中充分燃燒:
20.木炭還原氧化銅:
21.焦炭還原氧化鐵:
(2)煤爐中發生的三個反應:(幾個化合反應)
22.煤爐的底層:
23.煤爐的中層:
24.煤爐的上部藍色火焰的產生:
(3)二氧化碳的製法與性質:
25.大理石與稀鹽酸反應(實驗室制二氧化碳):
26.碳酸不穩定而分解:
27.二氧化碳可溶於水:
28.高溫煅燒石灰石(工業制二氧化碳):
29.石灰水與二氧化碳反應(鑒別二氧化碳):
30.石灰水與二氧化硫反應(所以反應中有硫元素的參與,澄清石灰水就不能鑒別二氧化碳)
(4)一氧化碳的性質:
31.一氧化碳還原氧化銅:
32.一氧化碳的可燃性:
其它反應:
33.碳酸鈉與稀鹽酸反應(化學反應式滅火器的原理):
(1)金屬與氧氣反應:
34.鎂在空氣中燃燒:
35.鐵在純氧中燃燒:
36.銅在空氣中受熱:
37.鋁在空氣中形成氧化鋁薄膜:
(2)金屬單質+酸→鹽+氫氣(置換反應)
38.鋅和稀硫酸(實驗室制氫氣)
39.鐵和稀硫酸
40.鎂和稀硫酸
41.鋁和稀硫酸
(3)金屬單質+鹽(溶液)→新金屬+新鹽
42.鐵和硫酸銅溶液反應:
43.鋅和硫酸銅溶液反應:
44.銅和硝酸汞溶液反應:
45.銅和硝酸銀反應:
46.鋁和硫酸銅溶液反應:
(4)鐵的冶鍊原理:
| 化學方程式 | 基本反應類型 | 反應現象 | 用途 |
|---|---|---|---|
| Cl2+H2=光照或點燃=2HCl | 化合反應 | 氫氣在氯氣中燃燒,發出蒼白色火焰,產生大量熱,有白霧生成 | 氯化氫的合成,製備鹽酸。 |
| 3Cl2+2P=2PCl3 | 化合反應 | 有白色煙霧生成 | — |
| Cl2+PCl3=PCl5 | 化合反應 | 有白色煙霧生成 | — |
| Cl2+2Na=2NaCl | 化合反應 | 有黃色火焰,放出大量熱,產生白煙。 | — |
| 3Cl2+2Fe=2FeCl3 | 化合反應 | 劇烈燃燒,生成棕褐色的煙。 | — |
| Cl2+2FeCl2=2FeCl3 | 化合反應 | 劇烈燃燒,生成棕褐色的煙。 | — |
| Cl2+Cu=CuCl2 | 化合反應 | 劇烈燃燒,生成棕黃色的煙。 | — |
| Cl2+2NaBr=2NaCl+Br2 | 化合反應 | — | — |
| Cl2+2NaI=2NaCl+I2 | 化合反應 | — | — |
| Cl2+Na2S=2NaCl+S | 化合反應 | — | — |
| Cl2+H2S=2HCl+S | 置換反應 | 剛開始有乳白色沉澱生成,隨後沉澱變成淡黃色 | — |
| Cl2+SO2+2H2O=H2SO4+2HCl | 氧化還原反應 | 試管內氣體褪色,試管口有刺激性氣味氣體逸出 | — |
| Cl2+H2O2=2HCl+O2 | 置換反應 | — | — |
| 2O2+3Fe=點燃=Fe3O4 | 化合反應 | 鐵在純氧中劇烈燃燒,火星四射,放出大量熱,生成黑色固體。 | — |
| O2+K=點燃=KO2 | 化合反應 | 鉀在純氧中燃燒,有淺紫色火焰,產生黃色固體。 | 製備超氧化鉀。 |
| 2K+O2=K2O2 | 化合反應 | — | — |
| S+H2=H2S | 化合反應 | — | — |
| S+2Cu=Cu2S | 化合反應 | 加熱熔融后反應,固體變黑。 | — |
| S+Zn=ZnS | 化合反應 | 加熱后劇烈反應,放出白光,產生大量熱。 | — |
| N2+3H2=高壓高溫催化劑=2NH3 | 化合反應 | 有刺激性氣味氣體逸出 | 工業合成氨 |
| N2+3Mg=點燃=Mg3N2 | 化合反應 | 鎂在氮氣中燃燒,發出耀眼白光,放出大量熱,產生淡黃色固體。 | — |
| H2+Br2=點燃=2HBr | 化合反應 | 氫氣在溴蒸汽中點燃,放出熱量,紅棕色逐漸褪去,產生白霧。 | — |
掌握化學方程式的書寫要領
左寫反應物,右邊寫生成,寫對化學式,係數來配平,中間連等號,條件要注清,生成沉澱氣,箭頭來標明。
歸類記憶
根據知識系列或反應類型或物質類別記憶,使零散的知識通過歸納成為有規律可循、以重點物質為中心的知識網路。
聯繫實驗現象記憶
化學方程式枯燥難記,如何使化學用語的學習有聲有色、興趣盎然,可聯繫實驗現象記憶。如硫在氧氣中燃燒,記憶聯想:燃硫入氧,燃燒變旺,火焰藍紫,美麗漂亮,產生氣體,可真夠“嗆”。磷在氧氣中燃燒,記憶聯想:紅磷燃燒,可真熱鬧,濃煙滾滾,亮似“燈泡”。