質子治療
用加速的質子和重離子為患者進行放射治療
1980年諾貝爾化學獎得主Ernest Rutherford在1919年發現了質子。哈佛大學的Robert Wilson首先提出用加速的質子和重離子為患者進行放射治療。他在醫學雜誌Radiology上發表了自己的這項提議。1977年,他還對其先導性工作做了個人評論。1899年,Rutherford從鈾元素中發現了α和β“射線”。隨後,他宣布α射線就是氦原子的原子核。1911年,他又發現原子的核子有極高的密度,僅占整個原子容積的很小部分,核子帶正電荷,是形成原子模型的基礎。第一次世界大戰後,他發現用α粒子照射氮氣後會產生氧原子和氫核,後者即為氫的原子核--質子。是有一個單元的正電荷的單粒子。他判斷質子是一個原始粒子,並將其命名為質子。
第二次世界大戰結束后不久,E. Lawrence及其同事創建了一台184英寸的340MeV質子同步回旋加速器。早在1929年,當E. Lawrence在閱讀WiderÖe寫的一篇高能加速器的文章之後,他就提出迴旋極速器的概念。1930年春,他和他的學生Edlefsen創造了一台回旋加速器。隨後,1930年秋,他的另一個學生M. Livingston也建造了一台直徑13cm的回旋加速器的模型。此模型具有所有早期回旋加速器的特點,一個半圓形的D型核子上的小於1000V的加速電極將質子加速到80,000eV。
質子治療
隨後,Lawrence團隊開始了高劑量質子照射垂體的I期臨床試驗。該試驗的原理基於大部分乳腺癌是激素依賴性的,消除垂體激素有利於這些患者的腫瘤消退。放療方案為總劑量140~300CGy,每周照射3次,共照射2周。治療時使用交叉照射技術,即用若干個小伎倆的340MeV質子束在垂體處彼此相互交叉,並由顱骨射出,即用每條束流的坪區的最大劑量照射垂體。1954年,首例患者接受了治療。在1992年,Berkeley加速器關閉,粒子束治療的研究隨之終止。
在Berkeley的第一例質子治療后的30年後,即1984年,全世界開設了質子治療中心總數為9個,均是附屬在核物理研究實驗室內。質子治療的開展都在核物理實驗室內進行,
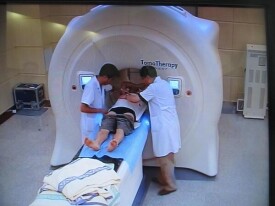
質子是一種帶正電荷的亞原子粒子。質子始於離子源,在不到1秒的時間內,氫原子會被分離成帶負電的電子和帶正電的質子。質子治療是一種使用電離輻射的外照射放療。治療期間,粒子加速器用質子束照射腫瘤。這些帶電粒子破壞腫瘤細胞的DNA,最終導致癌變細胞死亡或干擾其繁殖能力。因為癌變細胞的高分裂率以及修復受損的DAN能力降低,使得其DNA特別容易受到攻擊。以亞毫米的精確度瞄準腫瘤而不傷害周圍健康組織,同時還能將副作用降至最低。
質子治療
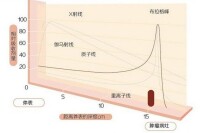
普通放射:X射線束由初級光子和二次電子組成的,他們沿著所述光束的路徑沉積他們的能力,瞄準的不僅是靶腫瘤,會輻射到位置腫瘤部位前後的健康組織。這種輻射“出束劑量”可能會在日後導致健康問題,因為他會損傷腫瘤或目標位置附近的正常組織或器官。
質子治療:質子進入人體後會形成一個獨特的“布拉格峰”,開始進入人體至峰前的劑量較低,峰時劑量迅速升高,峰后能量陡然降低至零。醫生可以控制質子釋放其大部分殺滅腫瘤能量釋放的位置。質子在體內移動時,它們會慢下來、與電子相互作用並釋放能量。其中,釋放最高能量的點叫做“布拉格峰”。醫生會確定布拉格峰的位置,對目標腫瘤細胞造成最大傷害。質子束與腫瘤的形狀和深度一致,同時不會傷害健康組織和器官。與適形調強(3D-CRT/IMRT)等其他放射治療方式比較,質子放療具有以下優勢:
1、高精確度,明顯提高對腫瘤的局部控制率;
2、低副作用,明顯減輕腫瘤周邊正常組織的損害及副作用,從而減少治療相關併發症;
3、高治癒率,提高腫瘤照射水平;
4、高安全性,減少第二原發腫瘤的發生率。
1、穿透性強:可根據病灶的部位和深度調節質子能量,使質子束到達人體的任意深度;
2、正常組織損傷小:病灶前面的劑量較低,後方劑量為0,正常組織受量減少;
3、靶區高劑量:通過Bragg峰,使病灶位於SOBP,從而獲得靶區內高劑量;
旁散射少:質子質量大,在物質內散射少,從而減少了周邊正常組織的照射劑量。
1、只對腫瘤病灶進行定點高能量照射,能獲得良好的治療效果;
2、能減輕容易受放射線影像的器官副作用,切實治療腫瘤病灶;
3、對身體的負擔小,老年患者或體質虛弱的患者也能接受治療;
4、能降低兒童和年輕患者放療后的第二原發腫瘤的發生;
5、因有併發症而無法進行手術的患者也能接受質子治療;
6、治療后不太會妨礙恢復正常社會生活和日常生活,能維持良好的生活質量。
對正常組織影像很小,但也並不能說完全沒有副作用,諸如有些患者照射部位的皮膚可能會出現如被日晒般的癥狀,部分患者會出現疲勞或者輕度脫髮。
所謂質子,就是指氫原子剝去電子后帶有正電荷的粒子。
氫原子通過加速器高能加速,成為穿透力很強的電離放射線,這就是質子放射線。
質子治療是放射線治療的一種。質子進入人體后,在射程終點處形成一個尖銳的劑量峰,稱為Bragg峰。通過調製能量展寬Bragg峰可以使Bragg峰覆蓋腫瘤。另外,質子入射通道上能量損失較小,側散射也很小,其前後左右正常組織所受劑量較小,故具有較好的放射物理學性能。
質子與電子、光子都是低LET輻射,放射生物學性能與下列參數有關:
1、氧增比(oxygen enhancement ratio ,OER)為乏癢細胞與富氧細胞產生相同程度生物效應所需劑量之比,它描寫了該種輻射的放射敏感性對細胞含氧量的依賴關係。
2、相對生物效應(relative biological effectiveness,RBE)為產生相同程度的生物效應時該種輻射所需劑量與Co的γ輻射所需劑量之比。
3、傳能線密度(linear energy transfer,LET)為沿次級粒子單位徑跡長度上的電離密度,其單位為KeV/μ。當LET低於10KeV/μ時,OER及RBE幾乎不變,OER高,RBE低。當LET高於10KeV/μ后,OER開始下降,RBE逐步上升。因此,稱10KeV/μ以下為低LET輻射,以上為高LET輻射。
在質子線治療中,可利用專門的機器和器具,結合布拉格峰的深度和患者不同病灶的形狀進行照射。因此可集中劑量,只瞄準病灶實施照射,同時降低了對正常組織的影響。
質子線照射使用的專用器具是准直儀和適形器,參照CT影像,利用專用的計算機系統進行設計,並根據照射方向為每位患者制定1~3套器具。
解讀詞條背後的知識