飽和溫度
液體處於動態平衡狀態時的溫度
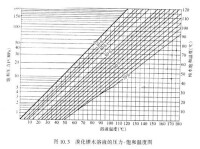
飽和溫度(saturation temperature)是指液體和蒸氣處於動態平衡狀態即飽和狀態時所具有的溫度ts。飽和狀態時,液體和蒸氣的溫度相等。飽和溫度一定時,飽和壓力也一定;反之,飽和壓力一定時,飽和溫度也一定。溫度升高,會在新的溫度下形成新的動態平衡狀態。物質的某一飽和溫度必對應於某一飽和壓力。最佳的飽和溫度並非一個固定值,它隨外界條件變化而變化。
飽和溫度
在氣化階段容器內的氣液具有相同的溫度。沸點與壓力的關係,和飽和溫度與飽和壓力的關係相同。因此,沸點就等於同樣壓力下的飽和溫度。二者雖然數值相等,但意義卻不同。飽和溫度是對於蒸發過程而言的,而沸點是對於沸騰過程。蒸發發生在氣液交互的表面,而沸騰發生在液體內部具有氣化核心的地方。所以二者的區別一定要把握清楚。把氣液共存的狀態叫處
冷凝過程是蒸發的反過程。對純物質,冷凝溫度也叫液化溫度,它等於相同壓力下的蒸發溫度。飽和溫度則可將二者統一起來。