緩衝對
緩衝對
從緩衝作用的原理可知,緩衝溶液一般由具有足夠濃度及適當比例的共軛酸鹼對組成,組成緩衝溶液的共軛酸鹼對的兩種物質合稱為緩衝對(buffer pair)。
系統 解離反應 pKa
蛋白質 HPr=H+ + Pr﹣ 7.4
碳酸氫鹽 H2CO3= H+ + HCO3﹣ 6.1
磷酸鹽 H2PO4﹣= H+ + HPO42﹣ 7.2
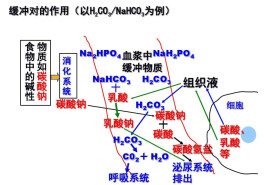
人體血漿里最重要的緩衝體系是碳酸氫鹽緩衝體系即
H2CO3= H+ + HCO3﹣
pH= pKa + lg〔HCO3﹣〕/〔H2CO3〕
在正常血漿中,〔HCO3﹣〕︰〔CO2〕= 20︰1
pH=6.10+lg20/1=7.40
人體各組織、細胞代謝產生的CO2,主要通過血紅蛋白和氧合血紅蛋白的運輸作用,被迅速運到肺部排出,故幾乎不影響血漿的pH,當產生比CO2酸性更強的酸(如磷酸、硫酸、乙酸等)時,血液中HCO3﹣/ CO2緩衝對便發揮緩衝作用,其中HCO3-可與代謝產生或外合產生CO2和H2O。增加的CO2大部分從肺部排出或通過血漿中蛋白質緩衝對和與之作用,,使〔CO2〕降低;減少的HCO3﹣可通過腎臟進行調節而得到補充,從而使
〔HCO3﹣〕,〔CO2〕和〔HCO3﹣〕/〔CO2〕都恢復正常。當人體新陳代謝過程中產生的鹼進入血液時,血液中的H3O+便立即與它結合生成水。H3O+的消耗有H2CO3的解離來補充,結果也使血液的pH 保持穩定。