電子能級
物理學名詞
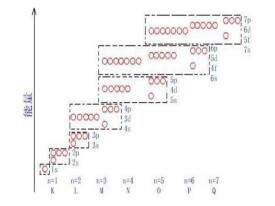
由玻爾的理論發展而來的現代量子物理學認為原子核外電子的可能狀態是不連續的,因此各狀態對應能量也是不連續的。這些能量值就是能級。能級是用來表達在一定能層上(K、L、M、N、O、P、Q)而又具有一定形狀的電子云的電子。
19世紀末20世紀初,人類開始走進微觀世界,物理學家提出了許多關於原子機構的模型,這裡就包括盧瑟福的核式模型。核式模型能很好地解釋實驗現象,因而得到許多人的支持;但是該模型與經典的電磁理論有著深刻的矛盾。
按經典電磁理論(19世紀末以前建立的物理學通常叫做經典物理學),電子繞核轉動具有加速度,加速運動著的電荷(電子)要向周圍空間輻射電磁波,電磁波頻率等於電子繞核旋轉的頻率,隨著不斷地向外輻射能量,原子系統的能量逐漸減少,電子運動的軌道半徑也越來越小,繞核旋轉的頻率連續增大,電子輻射的電磁波頻率也在連續地變化,因而所呈現的光譜應為連續光譜。
由於電子繞核運動時不斷向外輻射電磁波,電子能量不斷減少,電子將沿螺旋形軌跡逐漸接近原子核,最後落於核上,這樣,原子應是一個不穩定系統。
實驗事實:
原子具有高度的穩定性,即使受到外界干擾,也很不易改變原子的屬性;且氫原子所發出的光譜為線狀光譜,與經典電磁理論得出的結論完全不同。
能層(英語:Energy level)理論是一種解釋原子核外電子運動軌道的一種理論。它認為電子只能在特定的、分立的軌道上運動,各個軌道上的電子具有分立的能量,這些能量值即為能級。電子可以在不同的軌道間發生躍遷,電子吸收能量可以從低能級躍遷到高能級或者從高能級躍遷到低能級從而輻射出光子。氫原子的能級可以由它的光譜顯示出來。
能級躍遷首先由波爾(Niels Bohr)提出,但是波爾將宏觀規律用到其中,所以除了氫原子的能級躍遷之外,在對其他複雜的原子的躍遷規律的探究中,波爾遇到了很大的困難。
組成物質的原子中,有不同數量的粒子(電子)分佈在不同的能級上,在高能級上的粒子受到某種光子的激發,會從高能級跳到(躍遷)到低能級上,這時將會輻射出與激發它的光相同性質的光.
氫原子能級:原子各個定態對應的能量是不連續的,這些能量值叫做能級。
①能級公式:E=E/n
②半徑公式:r=r·n
在氫光譜中,
n=2,3,4,5,…...向n=1躍遷發光形成賴曼線系;
n=3,4,5,6……向n=2躍遷發光形成巴耳末線系;
n=4,5,6,7……向n=3躍遷發光形成帕邢線系;
n=5,6,7,8……向n=4躍遷發光形成布喇開線系,
其中只有巴耳末線系的前4條譜線落在可見光區域內。
③能量最低的能級叫做基態,其他能級叫做激發態。電子“遠離”原子核,不再受原子核的吸引力時的狀態叫做電離態,電離態的能級為0(電子由基態躍遷到電離態時,吸收的能量最大)。