米氏常數
研究酶促反應動力學的參數
米氏常數(Km)的含義是酶促反應達最大速度(Vm)一半時的底物(S)的濃度。它是酶的一個特徵性物理量,其大小與酶的性質有關。它被廣泛應用到生物化學、分子生物學、基因工程、生物製藥、臨床用藥等領域的理論、實驗和實踐中。
米氏常數(Michaelis constant,)(Km)
Km:米氏常數,是研究酶促反應動力學最重要的常數。
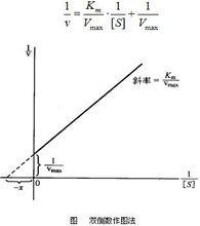
米氏常數
Km的意義及應用
(1)、活性中心被底物佔據一半時的底物濃度。當V=1/2Vmax時,Km=[S]。
(2)、Km是特徵常數,一般只與酶的性質、底物種類及反應條件有關,與酶的濃度無關。
(3)、Km可近似表示表示酶與底物的親和力
Km=(K2+K3)/K1=Ks+K3/K1
當K1、K2>>K3時,Km近似等於Ks,因此,1/Km可近似表示酶與底物的親和力大小
(4)、Km與天然底物
Km最小或最高Vm/Km比值的底物稱之為該酶的最適底物或天然底物。
(5)、已知Km,可根據[S]推算V,或由V推算[S]
(6)、了解酶的Km及[S]推知是否受[S]調節