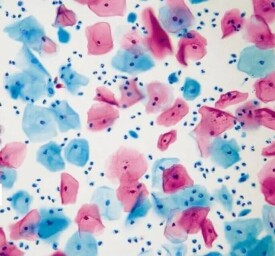
巴氏染色
巴氏染色
巴氏染色,染色有4個步驟:固定;核染色;胞漿染色;透明。
主要達到以下要求:1、核的結構清晰;2、透明度高;3、分色恰當。
固定的目的細胞製片的迅速固定是製片過程中關鍵的一步,否則會影響細胞學診斷的準確性。對於不同的標本需要不同的固定方法。最為常用的固定方法是95%酒精作為固定液的濕固定法。酒精作為一種脫水劑能夠防止細胞內的酶捋蛋白質分解而自容,並凝固細胞內的物質如蛋白質、脂肪和糖類等,使其保持與組織生活相仿的成分,從而使細胞各部分,尤其核染色質易於著色。對於巴氏染色來說,酒精固定最為重要的。如果酒精濃度不足引起的固定不佳,可造成細胞的人為變化,並可導致假陽性或假陰性的診斷。
1、固定方法濕固定法:作為用95%酒精固定液固定的細胞學標本一定使用濕固定法。製片製備完后,趁標本新鮮而又濕潤時,立即放入盛有95%酒精的固定缸內。製片在固定液內至少保持15-30min。固定時間通常不超過1周。這種製片染色后,顏色鮮艷,結構清晰。如果細胞製片需要送至另一實驗室或郵寄他處染色時,可以固定15min后,把製片取出后立即密封的容器中或者使用甘油防止製片乾燥。因為無論固定前或固定后的製片,如果發生乾燥后都會影響染色的效果。
2、固定注意事項固定液的過濾:為了防止細胞污染,凡是使用過的固定液,必須過濾后才能再使用。使用過長的固定液,必須用酒精相對密度計測定,酒精濃度低於90%時應該及時更換新液。濕固定的重要性:標本再新鮮時及時固定時保證染色效果的重要因素。如蘇木素對細胞核的染色,巴氏染色中胞漿的特殊著色作用,均可因標本乾燥后固定而大受影響。製片標本的郵寄:標本再固定15min后取出,立即加甘油數滴於製片上,裝入密封的小盒中。實驗室在收到標本后,先浸入95%酒精中,使甘油溶去,再進行染色。
1、蘇木素液浸染時間一般在3-5min,但是必須隨氣溫和染料情況而酌情改變。夏季或放置較久的蘇木素染液容易著色,時間要縮短;冬季或新配製的蘇木素染液和應用已久較稀釋的蘇木素液不易著色,時間要延長。在使用蘇木素染色時,一般有2種方法:
1)過染法:首先有意識地進行深染,然後通過鹽酸酸化過程使核染色趨於合適。這種方法能夠在酸化過程中把胞漿內黏附多餘的蘇木素染料去掉,使胞漿染色更為鮮艷、清晰、多用於黏液多的標本。
2)淡染法:在核染色過程中,嚴格掌握染色時間,使核染色適宜而不用鹽酸酸化,但是胞漿中少量的蘇木素會影響EA染色的質量。主要用於黏液少的標本,避免在酸化和自來水沖洗的過程中使細胞成片地脫落。在使用蘇木素染色時,一定要每日進行過濾,否則蘇木素結晶會影響染色的質量。一般蘇木素染液可以使用較長時間,所以每日增加少量新鮮染液即可。
2、鹼化鹼化亦稱返藍過程,可以使用飽和碳酸鋰或3%氨水鹼化,目的使蘇木素及早顯色,時間約數秒。更重要的是流水沖洗,可使藍色顯的更鮮艷。鹼性溶液亦需要充分漂清才不會妨礙下一步的胞漿著色及標本製成后的顏色保存。分化和鹼化溶液至少每天更換新液。
胞漿染色在巴氏方法中亦稱為OG—EA染色,它包括橘黃G(OG)和EA兩部分染色。由於橘黃G是一種小分子染料,能夠很快地作用於胞漿,一般染色時間不宜過長,通常1-2min。對於宮頸、陰道上皮中非正常角化細胞和角化型鱗癌細胞的胞漿中都可以出現鮮艷的橘黃色。
巴氏染色
細胞核著色不佳
(1)細胞核著色過淺:
1)鹽酸分化時間過長或蘇木素染液時間過長。需要縮短分化時間或延長鹼化時間;每日加入少量新鮮蘇木素染液或重新配製蘇木素液。
2)在固定之前製片乾燥。所以對巴氏染色的製片需要嚴格遵守濕固定的原則。
3)自來水的PH值偏酸性。使用鹼性溶液。
(2)細胞核著色過深:
1)鹽酸溶液濃度不夠。適當加入幾滴鹽酸以增加濃度。
2)製片用高於95%以上濃度的酒精固定后可以出現染色過深。應用95%酒精固定。
細胞漿著色不佳
(1)如果全片內胞漿都淡染,則需要延長染色時間或更換新液。
(2)如果胞漿不分色,均為淺紅色。製片在固定前乾燥或製片被有大量球菌樣細菌影響胞漿染色。此情況可以適當增加染色時間能夠部分糾正不分色狀況。
(3)胞漿染成灰色或紫色,是由於蘇木素染色時間過長或鹽酸分化不佳。經過褪色后重新蘇木素可以糾正。
(4)由於標本的不同,同樣配方的EA染液可造成偏藍、偏綠和偏紅,對不同的標本應該使用不同的EA染液。一般認為,EA36和EA50用於婦科標本,而EA65或改良EA用於非婦科標本。
(5)胞漿不分色的另一重要原因是由於EA染液的PH值不恰當所致。如染色為紅色,可以加少許磷鎢酸溶液糾正;如染色均為藍色或綠色,可以加少許飽和碳酸鋰溶液糾正。對於改良EA染液,每100ml染液加入2ml冰醋酸后染色效果更佳;染液使用更持久。