玻璃電極
玻璃電極
glass electrode
用對氫離子活度有電勢響應的玻璃薄膜製成的膜電極,是常用的氫離子指示電極。它通常為圓球形,內置0.1mol/L鹽酸和氯化銀電極或甘汞電極。使用前浸在純水中使表面形成一薄層溶脹層,使用時將它和另一參比電極放入待測溶液中組成電池,電池電勢與溶液pH值直接相關。由於存在不對稱電勢、液接電勢等因素,還不能由此電池電勢直接求得pH值,而採用標準緩衝溶液來“標定”,根據pH的定義式算得。玻璃電極不受氧化劑、還原劑和其他雜質的影響,pH測量範圍寬廣,應用廣泛。
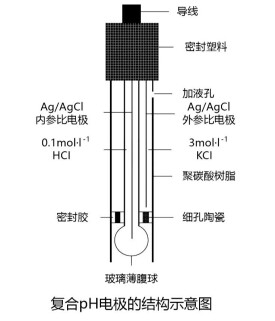
玻璃電極的主要部分是一個玻璃泡,泡的下半部是對H+有選擇性響應的玻璃薄膜,泡內裝有pH一定的0.1mol·L-1的HCL內參比溶液,其中插入一支Ag-AgCl電極作為內參比電極,這樣就構成了玻璃電極。玻璃電極中內參比電極的電位是恆定的,與待測溶液的pH無關。玻璃電極之所以能測定溶液pH,是由於玻璃膜產生的膜電位與待測溶液pH有關。玻璃電極在使用前必須在水溶液中浸泡一定時間。使玻璃膜的外表面形成了水合硅膠層,由於內參比溶液的作用,玻璃的內表面同樣也形成了內水和硅膠層。當浸泡好的玻璃電極浸入待測溶液時,水合層與溶液接觸,由於硅膠層表面和溶液的H+活度不同,形成活度差,H+便從活度大的一方向活度小的一方遷移,硅膠層與溶液中的H+建立了平衡,改變了膠-液兩相界面的電荷分佈,產生一定的相界電位。同理,在玻璃膜內側水合硅膠層-內部溶液界面也存在一定的相界電位。
其相界電位可用下式表示:Φ外=k1+0.059lga1/a1ˊ;Φ內=k2+0.059lga2/a2ˊ式中a1、a2分別表示外部溶液和內參比溶液的H+活度;a1ˊ、a2ˊ分別表示玻璃膜外、內水合硅膠層表面的H+活度;k1、k2分別為由玻璃膜外、內表面性質決定的常數。因為玻璃膜內外表面性質基本相同,所以k1=k2,又因為水合硅膠層表面的Na+都被H+所代替,故a1ˊ=a2ˊ,因此Φ膜=Φ外—Φ內=0.059lga1/a2,由於內參比溶液H+活度a2是一定值故:Φ膜=K+0.059lga1=K-0.059pH試,說明在一定的溫度下玻璃電極的膜電位與試液的pH呈直線關係。
PH玻璃電極的檢查
(1)把PH玻璃電極與參比電極放入pH7.00的標準緩衝溶液中,當參比電極用甘汞電極時毫伏讀數應為0+/-30毫伏;用Ag/AgCl電極作參比電極時,讀數應為0+/-80毫伏;
(2)放入pH4.00的緩衝溶液中,讀數應大於160毫伏;
(3)以玻璃電極為指示電極,甘汞電極為參比電極時,在25攝氏度pH值變化1個單位,其電位差的變化為59毫伏。
(4)如果讀數與上述範圍不符,應進行清洗;
PH玻璃電極的使用
(1)使用新PH電極要進行調整,放在蒸餾水中浸泡一段時間,以便形成良好的水合層;浸泡時間與玻璃組成、薄膜厚度有關,一般新制電極及玻璃電導率低、薄膜較厚的電極浸泡時間以24小時為宜;反之浸泡時間可短些。最近生產的玻璃電極包括E—201—C型、65—1Q型複合電極,因玻璃質量與製作工藝的提高,其說明書上都註明初用或久置不用的電極,使用時只需在3N的KCL溶液或去離子水中浸泡2—10小時即可;
(2)測定某溶液之後,要認真沖洗,並吸干水珠,再測定下一個樣品;
(3)測定時玻璃電極的球泡應全部浸在溶液中,使它稍高於甘汞電極的陶瓷芯端。
(4)測定時應用磁力攪拌器以適宜的速度攪拌,攪拌的速度不宜過快,否則易產生氣泡附在電極上,造成讀數不穩;
(5)測定有油污的樣品,特別是有浮油的樣品,用后要用CCI4或丙酮清洗乾淨,之後需用1.2mol/L鹽酸沖洗,再用蒸餾水沖洗,在蒸餾水中浸泡平衡一晝夜再使用;
(6)測定渾濁液之後要及時用蒸餾水沖洗乾淨不應留有雜物;
(7)測定乳化狀物的溶液后,要及時用洗滌劑和蒸餾水清洗電極,然後浸泡在蒸餾水中;
(8)玻璃電極的內電極與球泡之間不能存在氣泡,若有氣泡可輕甩點即讓氣泡逸出。
PH玻璃電極的維護
(1)如果電極上粘有油污,可用浸有CCl4或丙酮的棉花輕擦。然後放入0.1mol/LHCI溶液中浸洗12小時,再用蒸餾水反覆沖洗;
(2)平時常用的PH電極,短期內放在PH4.00緩衝溶液中或浸泡在蒸餾水中即可。長期存放,用PH7.00緩衝溶液或套上橡皮帽放在盒中。

玻璃電極