固相反應法
固相反應法
固相反應是固體間發生化學反應生成新固體產物的過程。固相反應有著不同的分類方式,按反應機理不同,分為擴散控制過程、化學反應速度控制過程、晶核成核速率控制過程和升華控制過程等;按反應物狀態不同,可分為純固相反應、氣固相反應(有氣體參與的反應)、液固相反應(有液體參與的反應)及氣液固相反應(有氣體和液體參與的三相反應);按反應性質不同,分為氧化反應、還原反應、加成反應、置換反應和分解反應。
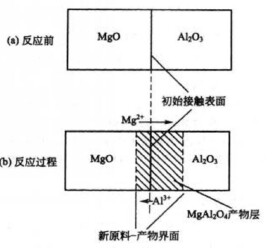
兩種或兩種以上的物質(質點)通過化學反應生成新的物質,其微觀過程應該是:反應物分子或離子接觸+反應生成新物質(鍵的斷裂和形成),在溶液反應中,反應物分子或離子可以直接接觸,在固相反應中,反應物一般以粉末形態混合,粉末的粒度大多在微米量級,反應物接觸是很不充分的。實際上固體反應是反應物通過顆粒接觸面在晶格中擴散進行的,擴散速率通常是固相反應速度和程度的決定因素。
①固體原料之間參加化學反應。
②因固體質點間作用力很大,擴散受到限制和反應濃度對反應物的影響很小,於是將固相反應分為相面反應和物質遷移兩個過程。
③固相反應開始溫度常遠低於反應物的熔點或系統低共熔溫度。這一溫度與反應物內部出現明顯擴散作用的溫度相一致,稱為泰曼溫度或燒結開始溫度。不同物質的泰曼溫度與其熔點(T)間存在一定的關係。當反應物之一存在多晶轉變時,此轉變溫度往往是反應開始變得顯著的溫度,這一規律稱為海德華定律。
先按規定的組成稱量、用水做為分散劑混合,為達到目的,需在球磨機內用瑪瑙球將兩相進行混合,混合均勻後用壓濾機脫水,在電爐上焙燒,加熱至粉末狀時,固相反應意外的現象也在同時進行:顆粒增長,燒結,且這兩種現象同時在原料和反應物間出現。
固相反應在室溫下進行的比較慢,為了提高反應速率,需要加熱至1000℃~1500℃,因此熱力學和動力學在固相反應中都有很重要的意義。
固相反應的原料和產物都是固體。原料以幾微米或更粗的顆粒狀態相互接觸、混合。固相反應分為產物成核和生長兩部分。通常,產物和原料的結構有很大不同,成核是困難的。因為在成核的過程中,原料的晶格結構和原子排列必須作出很大的調整,甚至重新排列。顯然,這種調整和重排要消耗很多能量,因而只能在高溫下發生。如果產物和某一原料在原子排列和鍵長兩方面都很接近,只需進行不大的結構調整就可以使產物成核,成核就比較容易發生。