反應焓
在定溫定壓下化學反應的焓變
化學反應過程中根據熱力學第一定律可表達成如下形式:
或
大量的實際化學反應過程是在溫度和體積或溫度和壓力近似保持不變的條件下進行的。對於定溫定容反應,因物系的體積不變,所以,這時式 成為:
式中 表示定溫定容反應時所得的有用功。對於微元反應,則
對於定溫定壓反應,若設反應前後物系的體積為 和,則物系所做的體積變化功為,又設 表示定溫定壓反應時所得的有用功,則式 可寫為
或
上式中仍有,熱力學能 中包含化學能,焓 中也包含化學能。對於微元反應,有
上述這些公式稱為熱力學第一定律的解析式。它們是根據第一定律得出的,不論化學反應是可逆的還是不可逆的,均可適用。若反應在定溫定容或定溫定壓下,不可逆的進行,且沒有做出有用功(因而這時反應的不可逆程度最大),則
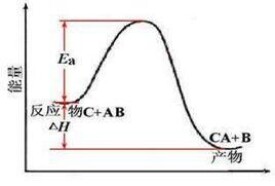
這時的反應稱為反應的熱效應,式中 和 分別稱為定容熱效應和定壓熱效應。上式指明定溫定容或定溫定壓下反應的熱效應等於反應前後的物系的焓差,這個焓差就稱為反應焓。
恆容反應焓和恆壓反應焓
(1)恆容反應焓:恆溫、恆容、非體積功為零時反應的焓變稱為恆容反應焓。
(2)恆壓反應焓:恆溫恆壓、非體積功為零時反應分焓變稱為恆壓反應焓。
背景:量熱學的發展, 已經由測量燃燒焓(氧彈:待測有機物在充滿氧氣的鋼彈中在電火花作用下引燃,通過測量氧彈外保溫杯中的水的溫度變化,用公式其中C為比熱),而至測量反應焓(反應量熱計)、混合焓(微量熱計); 測量的熱量由上千焦耳數量級而至幾十焦爾數量級;測量的反應,由燃燒反應而至絡合反應、中和反應、甚至細胞的生化過程;可測溫度差由0.001度到0.0001度。
反應焓測定是普通化學、無機化學教學的常規實驗。實驗用量熱計大致可分為兩種類型:即保溫杯型和燒杯夾泡沫塑料絕熱型;採用的攪拌方法則有手握量熱計搖動攪拌、手握玻璃棒(或下端加環)上下移動或轉動攪拌、電動攪拌機攪拌或電磁攪拌器攪拌。經過長期實踐,已發現現有各種簡易量熱計存在如下問題:(1)攪拌過程中容易碰破量熱計內壁或溫度計;(2)手動攪拌不充分、不均勻,反應時間長,由此帶來實驗誤差大;(3)燒杯夾泡沫塑料型量熱計,在清洗過程中夾層容易進水,熱容變化進而導致較大實驗誤差。反覆探索實踐的基礎上,研製出了使反應系統內的液體產生沖刷力進行攪拌的液力攪拌式量熱計,經實驗驗證,較完滿地解決了上述問題,可廣泛用於中和熱、焓變、稀釋熱、溶解熱的測量及測量實驗。