雙原子碳
雙原子碳
雙原子碳,分子式為C
| 雙原子碳 | |
IUPAC名 Diatomic carbon | |
系統名 ethenediylidene | |
| 識別 | |
| CAS號 | 12070-15-4 |
| PubChem | 139247 |
| ChemSpider | 122807 |
| SMILES | [C]=[C] |
| InChI | 1S/C2/c1-2 |
| InChIKey | LBVWYGNGGJURHQ-UHFFFAOYSA-N |
| Gmelin | 196 |
| ChEBI | 30083 |
| 性質 | |
| 化學式 | C |
| 摩爾質量 | 24.02 g·mol |
| 精確質量 | 24.000000000000 g mol |
| 若非註明,所有數據均出自一般條件(25 ℃,100 kPa)下。 | |
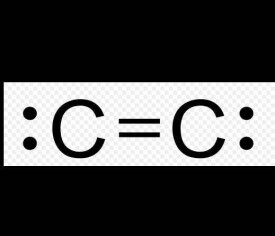
雙原子碳性質不穩定。
儘管價鍵理論認為,形成這種分子的唯一途徑是形成碳碳四鍵,以滿足八隅體規則。比較特殊的是,其中的σ鍵比π鍵更活潑,這是很少見的情況。然而,根據分子軌道理論,其中僅含有2個π鍵,而沒有σ鍵,為了能夠造成軌道間的最大重疊,鍵長比預計的小很多。
雙原子分子指所有由兩個原子組成的分子。雙原子分子內的化學鍵通常是共價鍵。
很多非金屬元素(包括氫、氮、氧、氟、氯、溴、碘等)的單質均是雙原子分子。其他元素(如磷)也可能以雙原子分子構成單質,但這些雙原子分子並不穩定。這些構成單質的雙原子分子稱為 同核雙原子分子。其中,氮和氧的同核雙原子分子佔地球大氣層成分的 99%。
π鍵,在化學上是共價鍵的一種。當兩個電子軌道的突出部分發生重疊時產生。
名字中的希臘字母π代表了p軌道,因為π鍵的軌道對稱性與p軌域相同。p軌道通常參與形成π鍵,然而,d軌道同樣能參與形成。
π鍵通常比σ鍵弱,因為它的電子云距離帶正電的原子核的距離更遠,需要更多的能量。量子力學的觀點認為,鍵的強度很弱主要是因為平行的p軌道間重疊不足。
價鍵理論( Valence bond theory, VB理論)是一種獲得薛定諤方程近似解的處理方法,又稱為 電子配對法。價鍵理論與分子軌道理論是研究分子體系的兩種量子力學方法。它是歷史上最早發展起來的處理多個化學鍵分子的量子力學理論。價鍵理論主要描述分子中的共價鍵及共價結合,核心思想是電子配對形成定域化學鍵。
分子軌道理論(英語:Molecular orbital theory),簡稱 MO理論,是處理雙原子分子及多原子分子結構的一種有效的近似方法,是化學鍵理論的重要內容。它與價鍵理論不同,後者著重於用原子軌道的重組雜化成鍵來理解化學,而前者則注重於分子軌道的了解,即認為分子中的電子圍繞整個分子運動。