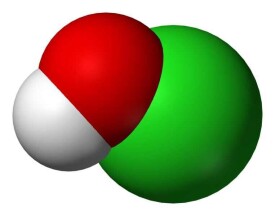
次氯酸
一種氯元素的含氧酸
次氯酸,一種氯元素的含氧酸,化學式為HClO,結構式H-O-Cl,其中氯元素的化合價為+1價,是氯元素的最低價含氧酸,但其氧化性在氯元素的含氧酸中極強,是氯元素含氧酸中氧化性第二強的酸。
它僅存在於溶液中,濃溶液呈黃色,稀溶液無色,有非常刺鼻的、類似氯氣的氣味,而且極不穩定,是一種很弱的酸,比碳酸弱,和氫硫酸相當。次氯酸也有極強的漂白作用,它的鹽類可用做漂白劑和消毒劑。
物質類別:無機酸
常溫下狀態:僅存在於水溶液中。水溶液在真空中可濃縮到密度1.282,即濃度40.1%。加熱到40℃時即分解,併發生爆炸。
顏色:無色到淺黃綠(顯色有變化是因為反應Cl₂+H₂O=HCIO+HCl是可逆反應,在不同狀態下平衡狀態也不同,顯黃綠色是因為溶有氯氣的原因)
氣味:有類似氯氣的刺激性氣味
溶解性(與水的體積比):1:2
弱酸性
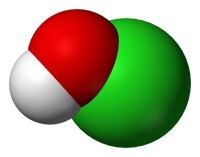
次氯酸的結構模型
強氧化性
次氯酸能氧化還原性物質(如NaSOFeCl,KI,CHON(石蕊)等),使有色布條、品紅褪色,並能使石蕊溶液變為無色液體。如:
NaSO + HClO = NaSO + HCl(強氧化劑制弱氧化劑,弱酸制強酸)
標準狀況次氯酸中性溶液是一種比標準狀況下的氯更強的氧化劑:
2 HOCl(aq) + 2 H+ 2 e⇌ Cl(g) + 2 HO E=+1.63V
註:標準狀況指0℃,標準大氣壓
不穩定性
次氯酸很不穩定,只存在於水溶液中。在光照的條件下,它按下式分解:2HClO=light=2HCl+O₂↑ 。它一般用作漂白劑、氧化劑、除臭劑和消毒劑。在水溶液中,次氯酸部分電離為次氯酸根ClO (也稱為次氯酸鹽陰離子)和氫離子H 。含有次氯酸根的鹽被稱為次氯酸鹽。最廣為人知的一種家用次氯酸鹽消毒劑是次氯酸鈉(NaClO)。因此,次氯酸具有強氧化作用和漂白作用,常用漂白粉的主要成分就是次氯酸鈣。當純凈的氯氣通入水中時,會形成次氯酸和氯化氫(HCl,鹽酸):Cl₂ + H₂O =可逆=HClO + HCl。次氯酸也是較弱的含氯酸,鹽酸的pH和鹼度均低於它。但有極強的氧化性和漂白作用,它的鹽類可用做漂白劑和消毒劑,次氯酸鹽中最重要的是鈣鹽,它是漂白粉(次氯酸鈣和鹼式氯化鈣的混合物)的有效成分。漂白粉可由氯和消石灰反應而製得:
3Ca(OH)₂+2Cl₂=Ca(ClO)₂+CaCl₂·xCa(OH)₂·yH₂O+H₂O
在放置漂白粉的地方具有氯的氣味,就是因為有一氧化二氯放出的緣故。
濃次氯酸溶液呈淡黃色的原因是因為其不穩定,自發分解:
2HClO=緩慢分解=HCl+O
HClO+HCl=可逆反應=HO+Cl
產生的Cl以分子形式溶於水呈淡黃色。
次氯酸在溶液中發生3種形式的分解,它們彼此無關,稱為平行反應,即:
1.2HClO =光= 2HCl+O₂↑
2.HClO+HCl =可逆= H₂O+Cl₂↑
3.3HClO =△= 2HCl+HClO₃
在陽光直接作用下,按第一種形式分解;在有脫水物質(如CaCl₂)存在時,按第二種形式分解;加熱時特別容易按第三種形式分解。如將氯通入熱鹼溶液中產物是氯酸鹽而不是次氯酸鹽:3Cl₂+6KOH=KClO₃+5KCl+3H₂O
一氧化二氯和水作用生成次氯酸:H₂O+Cl₂O=2HClO
氯氣與水反應生成次氯酸與鹽酸:H₂O+Cl₂=HCl+HClO
將氯氣通入混有碳酸鈣粉末的水中,次氯酸則積集在溶液中,蒸餾反應混合物,可以收集到稀次氯酸溶液。
2HClO=Cl₂O+H₂O(條件:CaCl₂)
次氯酸及其鹽類(易制爆),本品根據《危險化學品安全管理條例》受公安部門管制,但低濃度產品如消毒液不受管制。
實驗室製法:由次氯酸鈣與二氧化碳或草酸作用後過濾可得高純濾液。
高中課本製法:二氧化錳與濃鹽酸加熱製取氯氣,再與水作用
工業製法:由氯氣、四氯化碳·水與氧化汞共搖蕩后蒸餾而得。
Ca(ClO)₂+H₂O+CO₂=CaCO₃↓+2HClO
其他製法:由氯氣與水,生成次氯酸和鹽酸,用碳酸鈣增大濃度
2H₂O+2Cl₂+CaCO₃=CaCl₂+H₂O+CO₂+2HClO
次氯酸一般用作漂白劑、氧化劑和消毒劑。
含有次氯酸根的鹽被稱為次氯酸鹽。最廣為人知的一種家用次氯酸鹽消毒劑是次氯酸鈉(NaClO)。次氯酸具有強氧化作用和漂白作用,它的鹽類可用做漂白劑和消毒劑,次氯酸鹽中最重要的是鈣鹽,它是漂白粉(次氯酸鈣和鹼式氯化鈣的混合物)的有效成分。漂白粉可由氯氣和消石灰反應而製得:3Ca(OH)₂+2Cl₂=Ca(ClO)₂+CaCl₂·xCa(OH)₂·yH₂O+H₂O,在放置漂白粉的地方具有氯氣的氣味,是因為有一氧化二氯放出的緣故。
在生物學系統中,次氯酸可被視為白細胞例如中性粒細胞和單核細胞產生的毒性最強、丰度最高的氧化劑。次氯酸作為一種極強的氧化劑,可迅速攻擊多種生理學相關的分子,包括硫醇、硫醚、胺類、氨基酸、核苷酸、抗壞血酸和多烯酸。同時,次氯酸可生成反應性非常高的其他氧化劑,例如與H2O2和超氧陰離子反應可分別生成單線態氧和羥基自由基。
次氯酸作為消毒劑,被廣泛用於物體表面、織物等污染物品以及水、果蔬和食飲具等的消毒。除上述用途外,次氯酸還可用於室內空氣、二次供水設備設施表面、手、皮膚和黏膜的消毒。
S16Keep away from sources of ignition.遠離火源。
S26In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.不慎與眼睛接觸后,請立即用大量清水沖洗並徵求醫生意見。
S61Avoid release to the environment. Refer to special instructions / safety data sheets.避免釋放至環境中。參考特別說明/安全數據說明書。
S36/37Wear suitable protective clothing and gloves.穿戴適當的防護服和手套。
S45In case of accident or if you feel unwell, seek medical advice immediately (show the label whenever possible.)若發生事故或感不適,立即就醫(可能的話,出示其標籤)。
S7Keep container tightly closed.保持容器密封。
次氯酸應儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不超過30℃,相對濕度不超過80%。包裝要求密封,不可與空氣接觸。應與還原劑、酸類、易(可)燃物等分開存放,切忌混儲。不宜大量儲存或久存。儲區應備有合適的材料收容泄漏物。
次氯酸是外用消毒劑,不得口服,置於兒童不易觸及處。配製和分裝高濃度消毒液時,應戴口罩和手套;使用時應戴手套,避免接觸皮膚。如不慎濺入眼睛,應立即用水沖洗,嚴重者應就醫。次氯酸對金屬有腐蝕作用,對織物有漂白、褪色作用。金屬和有色織物慎用。次氯酸是強氧化劑,不得與易燃物接觸,應遠離火源。此外,次氯酸的包裝應標示相應的安全警示標誌。應依照具體產品說明書註明的使用範圍、使用方法、有效期和安全性檢測結果使用。
| 摩爾折射率 | 8.43 |
| 摩爾體積(cm/mol) | 37.4 |
| 等張比容(90.2K) | 87.3 |
| 表面張力(dyne/cm) | 29.6 |
| 極化率(10cm) | 3.34 |
| 疏水參數計算參考值(XlogP) | 0.3 |
| 氫鍵供體數量 | 1 |
| 氫鍵受體數量 | 1 |
| 可旋轉化學鍵數量 | 0 |
| 互變異構體數量 | 0 |
| 拓撲分子極性表面積 | 20.2 |
| 重原子數量 | 2 |
| 表面電荷 | 0 |
| 複雜度 | 2 |
| 共價鍵單元數量 | 1 |