免疫共沉澱
用於研究蛋白質相互作用的方法
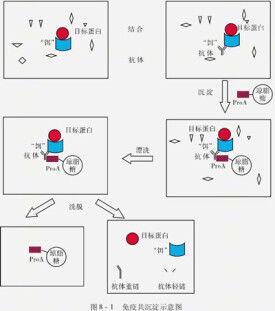
免疫共沉澱(Co-Immunoprecipitation)是以抗體和抗原之間的專一性作用為基礎的用於研究蛋白質相互作用的經典方法。是確定兩種蛋白質在完整細胞內生理性相互作用的有效方法。當細胞在非變性條件下被裂解時,完整細胞內存在的許多蛋白質-蛋白質間的相互作用被保留了下來。當用預先固化在argarose beads上的蛋白質A的抗體免疫沉澱A蛋白,那麼與A蛋白在體內結合的蛋白質B也能一起沉澱下來。再通過蛋白變性分離,對B蛋白進行檢測,進而證明兩者間的相互作用。
這種方法得到的目的蛋白是在細胞內與興趣蛋白天然結合的,符合體內實際情況,得到的結果可信度高。這種方法常用於測定兩種目標蛋白質是否在體內結合;也可用於確定一種特定蛋白質的新的作用搭檔。
(1)相互作用的蛋白質都是經翻譯后修飾的,處於天然狀態;
(2)蛋白的相互作用是在自然狀態下進行的,可以避免人為的影響;
(3)可以分離得到天然狀態的相互作用蛋白複合物。
(1)可能檢測不到低親和力和瞬間的蛋白質-蛋白質相互作用;
(2)兩種蛋白質的結合可能不是直接結合,而可能有第三者在中間起橋樑作用;
(3)必須在實驗前預測目的蛋白是什麼,以選擇最後檢測的抗體,所以,若預測不正確,實驗就得不到結果,方法本身具有冒險性。
(4)靈敏度沒有親和色譜高。
(1)轉染后24-48 h 可收穫細胞,加入適量細胞裂解緩衝液(含蛋白酶抑製劑),冰上裂解30min, 細胞裂解液於4°C,最大轉速離心30 min后取上清;
(2)取少量裂解液以備Western blot分析,剩餘裂解液加1μg相應的抗體加入到細胞裂解液,4°C緩慢搖晃孵育過夜;
(3)取10μl protein A 瓊脂糖珠,用適量裂解緩衝液洗3 次,每次3,000 rpm離心3 min;
(4)將預處理過的10μl protein A 瓊脂糖珠加入到和抗體孵育過夜的細胞裂解液中4°C緩慢搖晃孵育2-4h,使抗體與protein A瓊脂糖珠偶連;
(5)免疫沉澱反應后,在4°C 以3,000 rpm 速度離心3 min,將瓊脂糖珠離心至管底;將上清小心吸去,瓊脂糖珠用1ml裂解緩衝液洗3-4次;最後加入15μl的2×SDS 上樣緩衝液,沸水煮5分鐘;
(6)SDS-PAGE, Western blotting或質譜儀分析。
注意的問題:
(1)細胞裂解採用溫和的裂解條件,不能破壞細胞內存在的所有蛋白質-蛋白質相互作用,多採用非離子變性劑(NP40或Triton X-100)。每種細胞的裂解條件是不一樣的,通過經驗確定。不能用高濃度的變性劑(0.2%SDS),細胞裂解液中要加各種酶抑製劑,如商品化的cocktailer。
(2)使用明確的抗體,可以將幾種抗體共同使用。
(3)使用對照抗體:
單克隆抗體:正常小鼠的IgG或另一類單抗
兔多克隆抗體:正常兔IgG
(1) 確保共沉澱的蛋白是由所加入的抗體沉澱得到的,而並非外源非特異蛋白,單克隆抗體的使用有助於避免污染的發生;
(3) 確定蛋白間的相互作用是發生在細胞中,而不是由於細胞的溶解才發生的,這需要進行蛋白質的定位來確定。