免疫印跡法
免疫印跡法
免疫印跡法(Western blotting)是一種將高解析度凝膠電泳和免疫化學分析技術相結合的雜交技術。免疫印跡法具有分析容量大、敏感度高、特異性強等優點,是檢測蛋白質特性、表達與分佈的一種最常用的方法,如組織抗原的定性定量檢測、多肽分子的質量測定及病毒的抗體或抗原檢測等。
免疫印跡法(immunoblotting test,IBT)亦稱酶聯免疫電轉移印斑法(enzyme linked immunoelectrotransfer blot,EITB),因與Southern早先建立的檢測核酸的印跡方法 Southern blot 相類似,亦被稱為Western-blot.
原理
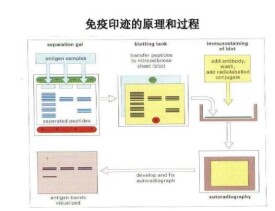
免疫印跡法 是將蛋白質轉移到膜上,然後利用抗體進行檢測。對已知表達蛋白,可用相應抗體作為一抗進行檢測,對新基因的表達產物,可通過融合部分的抗體檢測。
與Southern或Northern雜交方法類似,但Western Blot採用的是聚丙烯醯胺凝膠電泳,被檢測物是蛋白質,“探針”是抗體,“顯色”用標記的二抗。經過PAGE分離的蛋白質樣品,轉移到固相載體(例如硝酸纖維素薄膜)上,固相載體以非共價鍵形式吸附蛋白質,且能保持電泳分離的多肽類型及其生物學活性不變。以固相載體上的蛋白質或多肽作為抗原,與對應的抗體起免疫反應,再與酶或同位素標記的第二抗體起反應,經過底物顯色或放射自顯影以檢測電泳分離的特異性目的基因表達的蛋白成分。該技術也廣泛應用於檢測蛋白水平的表達。
1、SDS-PAGE試劑:見電泳實驗。
2、勻漿緩衝液:1.0M Tris-HCl(pH 6.8)1.Oml;10%SDS 6.0ml;β-巰基乙醇0.2ml;ddH2O 2.8ml。
5、膜染色液:考馬斯亮蘭0.2g;甲醇80ml;乙酸2ml;ddH2O118ml。包被液(5%脫脂奶粉,現配):脫脂奶粉1.0g溶於20ml的0.01M PBS中。
6、顯色液:DAB 6.0mg;0.01M PBS 10.0ml;硫酸鎳胺0.1ml;H202 1.0μl。
一蛋白質樣品獲得:細菌誘導表達后,可通過電泳上樣緩衝液直接裂解細胞,真核細胞加勻漿緩衝液,機械或超聲波室溫勻漿0.5-1min。然後4℃,13,000g離心15min。取上清液作為樣品。
二電泳:製備電泳凝膠,進行SDS-PAGE。
三轉移:(半乾式轉移)
1、電泳結束后將膠條割至合適大小,用轉膜緩衝液平衡,5min×3次。
2、膜處理:預先裁好與膠條同樣大小的濾紙和NC膜,浸入轉膜緩衝液中10min。
3、轉膜:轉膜裝置從下至上依次按陽極碳板、24層濾紙、NC膜、凝膠、24層濾紙、陰極碳板的順序放好,濾紙、凝膠、NC膜精確對齊,每一步去除氣泡,上壓500g重物,將碳板上多餘的液體吸干。接通電源,恆流1mA/cm2,轉移1.5hr。轉移結束后,斷開電源將膜取出,割取待測膜條做免疫印跡。將有蛋白標準的條帶染色,放入膜染色液中50s后,在50%甲醇中多次脫色,至背景清晰,然後用雙蒸水洗,風乾夾於兩層濾紙中保存,留與顯色結果作對比。
四免疫反應:
1、用0.01M PBS洗膜,5min×3次。
2、加入包被液,平穩搖動,室溫2hr。
3、棄包被液,用0.01M PBS洗膜,5min×3次。
4、加入一抗(按合適稀釋比例用0.01M PBS稀釋,液體必須覆蓋膜的全部),4℃放置12hr以上。陰性對照,以1%BSA取代一抗,其餘步驟與實驗組相同。
5、棄一抗和1%BSA,用0.01M PBS分別洗膜,5min×4次。
6、加入辣根過氧化物酶偶聯的二抗(按合適稀釋比例用0.01M PBS稀釋),平穩搖動,室溫2hr。
7、棄二抗,用0.01M PBS洗膜,5min×4次。
8、加入顯色液,避光顯色至出現條帶時放入雙蒸水中終止反應。
1、一抗、二抗的稀釋度、作用時間和溫度對不同的蛋白要經過預實驗確定最佳條件。
2、顯色液必須新鮮配置使用,最後加入H2O2。
3、DAB有致癌的潛在可能,操作時要小心仔細。