辣根過氧化物酶
辣根過氧化物酶
過氧化物酶,通常來源於辣根(因此稱辣根過氧化物酶),是臨床檢驗試劑中的常用酶。該產品不但廣泛用於多個生化檢測項目,也廣泛運用於免疫類(ELISA)試劑盒。過氧化物酶作為多個試劑盒顯色體系的關鍵成分,對試劑盒的質量有重要影響。
過氧化物酶,酶學分類號為EC 1.11.1.7。
Donor+ H2O2--→Oxidized donor+2 H2O。
辣根過氧化物酶(Horseradish Peroxidase,HRP)比活性高,穩定,分子量小,純酶容易製備,所以最常用。HRP廣泛分佈於植物界,辣根中含量高,它是由無色的酶蛋白和棕色的鐵卟啉結合而成的糖蛋白,糖含量18%。HRP由多個同工酶組成,分子量為40,000,等電點為PH3~9,酶催化的最適PH因供氫體不同而稍有差異,但多在PH5左右。酶溶於水和58%以下飽和度硫酸銨溶液。HRP的輔基和酶蛋白最大吸收光譜分別為403nm和275nm,一般以OD403nm /OD275nm的比值RZ(德文Reinheit Zahl)表示酶的純度。高純度的酶RZ值應在3.0左右(最高可達3.4)。RZ值越小,非酶蛋白就越多。
1) RZ>3 活性 >250u/mg,主要應用於免疫學,是高純度的過氧化酶。採用特殊色譜純化技術以除去會影響免疫學反應的同工酶B .
2) RZ>2 活性 >180u/mg ,主要應用於臨床化學,我們的客戶也有將這個規格的產品應用於免疫學研究的。此時,一個標準化的分析方法就變得尤為重要。
3) RZ>1 活性 >100u/mg,主要應用於血糖試紙和尿液分析試紙。
4) RZ>0.6 活性 >60u/mg ,主要應用於尿液分析試紙。
過氧化物酶催化以下反應:
2 H2O2 →O2+2H2O
這一類酶以鐵卟啉為輔基,所以屬血紅素蛋白質類(hemeProteins)。過氧化物酶在生物界分佈極廣,在細胞代謝的氧化還原過程中起重要的作用。
本實驗是以辣根為原料,經過水的抽提,硫酸銨和丙酮分級分離,再經鋅離子純化,透析除鹽,冷凍乾燥,最後製得高純度的辣根過氧化物酶。
辣根過氧化物酶分子量在40,000左右,是一種含亞鐵血紅素的蛋白質,等電點7.2;易溶於水,溶解度為5%(W/V),溶液呈棕紅色,透明;也溶於0.58飽和度以下的硫酸銨溶液,而0.62飽和度以上則不溶。該酶最適pH為7.0(對愈創木酚為氫給體而言)。在室溫下HRP在幾周內保持穩定,加熱到63℃后15分鐘內穩定。
辣根過氧化物酶氧化還原電勢很低,pH6.08時,E’0= -0.2070v;pH為7.71時,E’0= -0.5787v。
辣根過氧化物酶的作用機理可分以下幾步:
第一步
複合物Ⅰ+AH→複合物Ⅱ+A
第三步
在一定程度上複合物Ⅱ可自發地分解成HRP和產物(P),亦可與過量的過氧化氫形成無活性的複合物Ⅲ。
辣根過氧化物酶的活力測定方法有多種,主要原理介紹如下:
1、Rz值,提純工作的後幾步以及純酶溶液可用Rz值表明酶的純度。
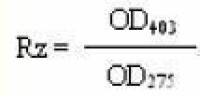
辣根過氧化物酶
2、愈創木酚法:測k4[見反應式⑶]。以愈創木酚(鄰甲氧基酚,guaiacol)為氫給體,其反應如下:
辣根過氧化物酶
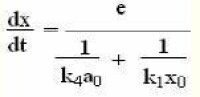
辣根過氧化物酶
α0—氫供體起始濃度;
x0為過氧化氫的起始濃度。
如果測定的條件選擇成k4α0》k1x0,可以測得k1:
辣根過氧化物酶

辣根過氧化物酶
所以 所以:
辣根過氧化物酶
辣根過氧化物酶
—測定過程中底物減少的速度。
本實驗是採用測定k4的方法來判斷酶的純度。
上述測定Rz值和k4值的方法雖然比較簡單,但都不能測得酶的實際活力單位。測定過氧化物酶的傳統方法是連苯三酚試驗法,以過氧化氫為底物,在酶作用下,連苯三酚可形成紅棓酚(Purpurogallin),在430nm處測定產物的形成。用紅棓酚值(PZ)表示酶的活力。PZ表示在標準測定條件下1毫克酶所形成的紅棓酚微克數。
儀器
離心機、乾燥器、分光光度計。
試劑
⒈ 硫酸銨:工業純和化學純;
⒉ 丙酮。
⒋ 20mM愈創木酚溶液:取0.22毫升愈創木酚加水至100毫升。
⒌ 40mM過氧化氫溶液:取0.4毫升30%過氧化氫加水至100毫升(如測k1則用10mM過氧化氫溶液)。臨用前配製。
⒍ 5%乙酸鋇溶液
⒎ 奈氏試劑
⒏ 0.1 mol/L硝酸銀溶液
(一)HRP的製備
⒈水提取:
稱取 10斤用水沖刷乾淨的鮮辣根(辣根皮中亦含有豐富的HRP),用菜刀切成小碎塊,在攪肉機中攪碎1~2次。碎渣漿用1倍體積的水在低溫下攪拌提取過夜(亦可採用高速抽提法)。次日用甩干機(或離心機)甩干,收集濾液,碎渣再用1/4倍體積水浸泡提取一次,合併兩次濾液,量總體積和度,0。
⒉硫酸銨分級分離:
在不斷攪拌下,每升濾液中慢慢加入226克硫酸銨粉末(相當於0.40飽和度),大約在1~2小時內加完,置冷室中放置過夜。次日將上清液小心地用虹吸管移出,下面渾濁液以3000轉/分離心15分鐘,棄沉澱,合併上清液。再按每升上清液加258克硫酸銨粉末(0.8飽和度)隨加隨攪拌,當硫酸銨全部溶解后,置冷室過夜。次日,虹吸出上清液,沉澱部分在冰凍離心機中以13000轉/分離心20分鐘,棄去上清液,收集沉澱。將沉澱懸浮於100~150毫升蒸餾水中(加水量要使沉澱全部溶解為止),分裝於透析袋內,放在流動自來水中進行透析1~2天,直到硫酸銨透析完畢為止(可用5%乙酸鋇溶液或奈氏試劑進行檢查)。然後改換成用蒸餾水透析,中間更換2~3次,用0.1 mol/L硝酸銀溶液檢查透析外液無氯離子為止。
將透析液合併,在冰凍離心機中以 4000轉/分離心 15分鐘;去沉澱,量上清液的體積。
⒊丙酮分級分離:
將上清液倒入燒杯並置冰鹽浴中,在不斷攪拌下,用細滴管沿杯壁加入1倍體積預冷至-15℃的丙酮,放置片刻,在冰凍離心機中以4,000/分離心15分鐘,棄去沉澱。上清液再加入0.8體積(按原上清液體積)-15℃丙酮,(操作同上),靜置后,在冰凍離心機中離心收集沉澱。將沉澱溶於少量蒸餾水中,透析除丙酮。可得Rz值近於1的酶溶液。
⒋精製:
將上步酶液適當稀釋,滴加1M硫酸鋅溶液,使酶液中鋅離子濃度為10-3M,5000轉/分離心10分鐘,得上清液。再將沉澱用少量蒸餾水洗滌,離心,洗液與清液合併,分裝於透析袋內,對水透析除鹽,用微孔濾膜過濾,進行真空冷凍乾燥(約得20毫克),產品呈米黃色纖維狀鬆軟物,HRP產品的Rz值可達3.0左右,置真空乾燥器中低溫保存。
(二)HRP的活力測定
⒈活力測定:測定k4值的方法操作如下:
取2個比色池(帶蓋,光程1厘米),按下表加入反應物
辣根過氧化物酶
加好反應物,搖勻,在470nm 讀出OD值,為t=0 的讀數。立即加0.01毫升40mM過氧化氫溶液於2個比色池中,即刻搖勻並記時,每隔30秒鐘讀數一次,約5分鐘。並記下實驗時的室溫。
將所測樣品的OD值減去相應時間對照的OD值,然後以OD值為縱坐標,時間為橫坐標作圖。得一直線,計算出平均每分鐘光密度的增加值,即求出△x/△t,按公式⑻求出k4值。實際的實驗值k4 = 2.2×10,k4 = 3.1×10,而k4 應當為3.3×10。該方法用於測定粗的無細胞提取液誤差較大。
因為某些物質可干擾四鄰甲氧基連酚的形成。
或不求k4值,而把在上述條件下,每分鐘OD470增加0.001所需酶量定為1個HRP活力單位。
⒉蛋白質含量的測定:
將酶液適當稀釋后,用 Folin一酚試劑法比色測定蛋白質含量。
