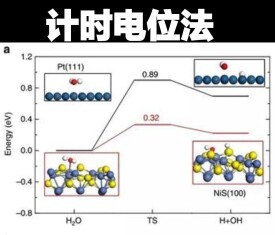
計時電位法
計時電位法
計時電位法是一種電化學分析法和研究電極過程的電化學技術。
它的基本原理是電解,與極譜法(見極譜法和伏安法)更相近。在極譜法中得到的是表示電極電位 E和電流 i之間的關係的 曲線;此法則是在某一固定電流下,測量電解過程中電極電位(見電極電勢)與時間 t之間的關係的 曲線,故稱計時電位法。
此法的儀器用一個可調的恆電流源,由一個工作電極(即溶液中某物質能在上面進行氧化或還原的電極)、一個對電極(輔助電極)和一個參比電極組成的三電極電解池,用線路連接電位儀和記錄儀(或示波器),便可以描繪出發生電極反應時電位隨時間變化的曲線。
電極是靜止的,溶液也不攪動,所以傳質過程主要靠擴散,這點與極譜法相似,但工作電極不用滴汞,在還原過程中用懸汞或汞池電極;在氧化過程中用鉑、金、碳化硼和碳糊電極,這一點又與伏安法相似。對電極一般用鉑電極,參比電極用甘汞電極或銀-氯化銀電極。
1901年H.J.S.桑德用恆電流電解求離子擴散係數,並根據擴散定律和能斯脫方程推導了平面電極上的電流、時間和電活性物(或稱去極劑)之間的關係式,稱為桑德方程:
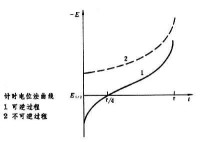
曲線