共軛體系
共軛體系
共軛體系是能形成共軛π鍵的體系。一般地,多個原子上的相互平行的p軌道,連貫重疊在一起構成一個整體, p電子在多個原子間運動,產生的和普通兩原子間π鍵不同的鍵稱為離域π鍵 (也稱作共軛π鍵,大π鍵)。
在整個共軛體系中垂直於原子實和σ鍵構成的平面型骨架的p軌道上的這些電子,在整個體系中運動,使得體系中原子間有一種特殊的相互影響,因而產生了一種使共軛體系比非共軛體系更加穩定,內能更小,鍵長趨於平均化的效應,稱為共軛效應。最典型的共軛體系有1,3-丁二烯和苯等有機分子。
(1)分子中參與共軛的原子處於同一平面上 通過討論1,3一丁二烯的分子結構可以看出,共軛體系中各原子必須在同一平面上。
(2)P軌道互相平行每個原子必須有一個垂直於該平面的P軌道。
(3)P電子數小於p軌道的2倍若P電子數等於P軌道的2倍,則軌道全充滿,就不能形成共價鍵,也就無法形成共軛。
(1)π-π共軛體系
只要是兩個不飽和鍵通過單鍵相連,就可以形成π-π共軛體系。例如:
CH=CH-CH=CH(雙鍵和雙鍵形成的π-π共軛體系)
CH=CH-CH=O(碳碳雙鍵和碳氧雙鍵形成的π-π共軛體系)
CH=CH-C≡N(碳碳雙鍵和碳氮三鍵形成的π-π共軛體系)
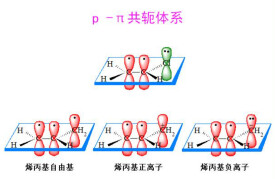
(2)p-π共軛體系
如果與π鍵相連的某一原子具有一個與π鍵相平行的p軌道,那麼這個p軌道就可以和π鍵離域,形成p-π共軛體系。例如:
CH=CH-O-CH;CH=CH-NH-CH;CH=CH-Cl
(3)超共軛體系
超共軛效應是由σ(Csp-Hs)鍵參與的共軛效應,分為σ-π超共軛,即σ(Csp-Hs)鍵與π鍵的共軛,和σ-p超共軛,即σ(Csp-Hs)鍵與p軌道的共軛。
σ-π超共軛:CHC≡CCH形成6個σ-π超共軛;CH=CH-CH形成3個σ-π超共軛
σ-p超共軛:(CH)C+形成9個σ-p超共軛;CHCH形成3個σ-p超共軛
在共軛體系中,雖然各原子間訂電子云密度不完全相同,但由於竹電子離域,使得單雙鍵的差別減小,鍵長有趨於平均化的傾向。共軛體系越長,單雙鍵差別越小。另外,由於竹電子離域作用,共軛體系能量降低,因而共軛體系比非共軛體系更加穩定。這可以從它們的氫化熱的數據得到證明。
CHCH=CHCH=CH+2H——> CHCHCH2CHCH+226.4kJ/mol
CH=CHCHCH=CH+2H——>CHCHCHCHCH+254kJ/mol
同是加2mol的H,但放出的氫化熱卻不同,這是因為反應物的能量不同。這個能量上的差值通稱為離域能或共軛能,它是由於耵電子的離域引起的,是共軛效應的表現,其離域能越大,體系能量越低,化合物則越穩定。
在單烯烴中碳碳雙鍵上的π電子的運動範圍,局限在兩個碳原子之間,稱為定域運動。在雙鍵單鍵雙鍵共軛的體系,如1,3-丁二烯分子中4個碳原子上的π電子的運動範圍,已不局限於兩個碳原子之間,而是在4個碳原子的分子軌道中運動,稱為離域現象。π電子的離域現象使得電子云的密度分佈有所改變,內能降低,分子更趨於穩定,鍵長趨於平均化。在這種分子中,任何一個原子受到外界試劑的作用,其他部分立即受到影響,其作用貫穿在整個體系中。這種電子通過共軛體系的傳遞方式叫做共軛效應。
共軛效應是存在於共軛體系中的一種極性和極化現象,是一個分子在靜止狀態和在反應過程時的特性,前者是靜態的,而後者是動態的。共軛效應和誘導效應相似,都引起分子中電子密度分佈不均勻,都屬於電子效應。與誘導效應不同的是,共軛效應是通過π鍵傳遞的,而且隨產生影響的基團和分子中受到影響部分之間距離的增加而降低的速度不明顯。共軛效應在體系的物理性質和化學行為上都有所反映。
一般形成共軛π鍵必須滿足兩個條件:共軛的原子必須同在一個平面上,並且每個原子可以提供一個彼此平行的p軌道;總的π電子數小於參與形成離域π鍵的p軌道數的2倍。但有的實驗數據表明,有些滿足這兩個條件的分子體系並不一定能形成離域π鍵而出現共軛體系所應有的性質。
共軛效應對物質的電性、顏色、酸鹼性等許多性質都有一定的影響。由於共軛體系中π電子的離域而使得共軛體系的能量比非共軛體系的能量下降,降低的能量稱為離域能,即價鍵理論中的共振能。
1931年休克爾(Huckel)提出了一個適用於平面共軛分子體系的簡化的近似分子軌道法,即HMO法。其主要思想是對這樣的體系進行σ-π電子分離近似,並在處理π電子的計算中做進一步的近似。此法雖相對有些粗糙,但它不僅對分子的離域π鍵能給以本質的描述,而且簡單實用,特別是計算出的電荷密度、鍵級、自由價等參量,在化學理論研究和實際應用中都很有價值。
在某些體系中,有些原子或基團的σ軌道可以與相鄰原子的p軌道或相鄰體系的π軌道互相交蓋而形成離域軌道,並因此而改變有關化學鍵和分子的性質。這樣的效應稱為超共軛效應(分別稱為σ-p超共軛和σ-π超共軛)。