共找到2條詞條名為碳酸氫根的結果 展開
- 碳酸氫根
- 碳酸氫鹽
碳酸氫根
碳酸氫根
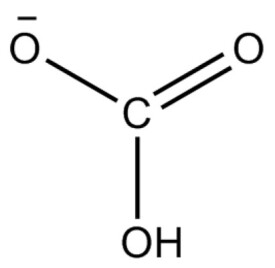
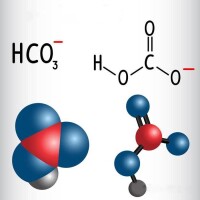
碳酸氫根(HCO3)的原子排布為平面結構,碳位於中心,與三個氧原子鍵連(一個C=O,一個C-OH,一個C-O)。它是碳酸的共軛鹼,也是碳酸根離子的共軛酸。水溶液中存在下列平衡,碳酸氫根既可發生電離生成碳酸根離子(CO3)和氫離子(H),也會水解生成氫氧根離子(OH)和碳酸(H2CO3),由於碳酸氫根的水解(產生OH)程度大於電離(產生H)程度,因此其水溶液呈弱鹼性。
碳酸氫根
碳酸根和碳酸氫根這兩種都是離子,而且是弱酸根離子,都容易存在於鹼性條件下,碳酸根酸性弱於碳酸氫根,因此更容易水解,所以碳酸根水溶液的鹼性強於碳酸氫根的水溶液。碳酸根離子的水解程度較大,碳酸氫根結合的鹽大部分是可溶性鹽,而碳酸根離子結合的鹽很多是不可溶的,碳酸氫根可以和氫氧根結合生成碳酸根和水。碳酸氫根和碳酸不反應,如果反應碳酸氫根失去一個H變為碳酸,碳酸得到一個H變為碳酸氫根,這跟沒反應一樣。碳酸氫根和醋酸,磷酸都反應,磷酸是中強酸。
HCO3 + H ⇌ H2O + CO2↑
HCO3+ OH ⇌ H2O + CO3
碳酸氫根與金屬離子產物的溶解性
碳酸氫根離子不能和氫氧離子大量共存,強調的是“大量”。實際上這兩個離子是可以少量共存的。這牽涉到溶液中的離子平衡問題。任何溶液中都有一個動態的離子平衡,兩種離子的濃度的某次方之積為定值,其中的常數叫做“化學平衡常數”。這就限制了離子的最大濃度,若超過了這個極限,離子濃度就會因反應生成氣體或沉澱等而自動下降回到平衡狀態。