鍵能
反映分子穩定性的數值
化學鍵能指1.01*10^5Pa和25攝氏度下(常溫常壓下),將1mol理想氣體分子AB拆開為中性氣態原子A和B所需要的能量(單位為KJ·mol)鍵能越大,化學鍵越牢固,含有該鍵的分子越穩定。鍵能通常通過熱化學方法或光譜化學實驗測定離解能得到,我們常用鍵能表示某種鍵的強弱。
鍵能的數值通常用該溫度下該反應的標準摩爾反應焓變表示,如不指明溫度,應為298.15K。
鍵能
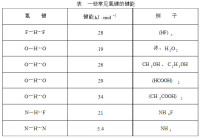
對生物體來說,儲藏在化學鍵中的能量是一種重要的自由能。所謂自由能,就是能夠用來做功的能量。食物中的自由能有相當一部分是以熱的形式散發出去,這些熱不能再被用來做功。不管怎麼說,所有形式的能量最終都要轉化為熱能,因此能量的測度通常採用熱的單位,如千焦(kJ)、千卡(kcal)。生物分子中化學鍵能的大小與許多因素有關,其中主要的因素是被鍵連接在一起的原子間電負性差異(如表)。具有較小鍵能的鍵容易被破壞,即這種鍵本身較弱、較不穩定。在每一生物化學反應中都以ΔG0’表示特定的標準自由能變化,“+”號表示能量並未喪失而是儲藏在產物中,“-”號表示能量從反應系統中釋放出來。
鍵能是表徵化學鍵強度的物理量,可以用鍵斷裂時所需的能量大小來衡量。在101.3kPa和298K下,將1mol氣態分子AB斷裂成理想氣態原子所吸收的能量叫做AB的離解能(KJ·mol),常用符號D(A-B)表示。即:AB
在多原子分子中斷裂氣態分子中的某一個鍵所需的能量叫做分子中這個鍵的離解能。例如:
分子中雖然有三個等價的N-H鍵,但先後拆開它們所需的能量是不同的。所謂鍵能(Bond Energy)通常是指在,鍵能用E表示。顯然對雙原子分子來說,鍵能等於離解能,例如,298.15K時,H的鍵能E;而對於多原子分子來說,鍵能和離解能是不同的。例如NH分子中N-H鍵的鍵能應是三個N-H鍵離解能的平均值:
鍵能通常通過熱化學方法或光譜化學實驗測定離解能得到,我們常用鍵能表示某種鍵的強弱。
(註:鍵能大小並不能被用於表示物質能量多少,而只表示物質與達到活潑態時自由能之差)
由鍵能求焓變公式:反應物的總鍵能-生成物的總鍵能
鍵能與物質本身的關係:鍵能越大,本身能量就越低,鍵能越小,本身能量越高。做為反應物的物質,在反應過程中需要吸熱,產生上述原因是因為:能量低,本身結構穩定,需要吸收更多的熱量,鍵能大。能量高,本身結構不穩定,需要吸收的熱量低,鍵能小。
鍵能是化學鍵形成時放出的能量或化學鍵斷裂時吸收的能量,可用來標誌化學鍵的強度。它的數值是這樣確定的:對於能夠用定域鍵結構滿意地描述的分子,所有各鍵的鍵能之和等於這一分子的原子化能。鍵能是從定域鍵的相對獨立性中抽象出來的一個概念,它的定義中隱含著不同分子中同一類型化學鍵的鍵能相同的假定。實驗證明,這個假定在一定範圍內近似成立。例如,假定C─C和C─H鍵的鍵能分別是346和411千焦/摩,則算出來的飽和烴的原子化能只有2%的偏差。
通常給出的鍵能數值實際上是鍵焓而非鍵能,而且常常是298K時的值而不是0K時的值。但是這種差別不大,一般不必加以區別。
常用的另一個量度化學鍵強度的物理量是鍵離解能,它是使指定的一個化學鍵斷裂時需要的能量。由於產物的幾何構型和電子狀態在逐步改變時伴隨有能量變化,除雙原子分子外,鍵離解能不同於鍵能。例如,依次斷開 CH的四個 C─H鍵的鍵離解能分別是425、470、415、335千焦/摩,它們的平均值才等於C─H鍵的鍵能(411千焦/摩)。
| 化 學 鍵 | 鍵 長 /(10^-12m) | 鍵 能 / (kJ/mol) | 化 學 鍵 | 鍵 長 /(10^-12m) | 鍵 能 / (kJ/mol) |
| B—F | - | 644 | N—H | 101 | 391 |
| B—O | - | 515 | N—N | 145 | 159 |
| Br—Br | 229 | 193 | N═N | 125 | 456 |
| C—B | 156 | 393 | N≡N | 110 | 946 |
| C—Br | 194 | 276 | N—O | 146 | 230 |
| C—C | 154 | 332 | N═O | 114 | 607 |
| C═C | 134 | 611 | Na—Br | 250 | 367 |
| C≡C | 120 | 837 | Na—Cl | 236 | 412 |
| C—Cl | 177 | 328 | Na—F | 193 | 519 |
| C—F | 138 | 485 | Na—H | 189 | 186 |
| C—H | 109 | 414 | Na—I | 271 | 304 |
| C—I | 214 | 240 | O—H | 98 | 463 |
| C—N | 148 | 305 | O—O | 148 | 146 |
| C═N | 135 | 615 | O═O | 120 | 496 |
| C≡N | 116 | 891 | P—Br | 220 | 272 |
| C—O | 143 | 326 | P—Cl | 203 | 331 |
| C═O | 120 | 728 | P—H | 142 | 322 |
| C═O(CO2) | - | 803 | P—O | 163 | 410 |
| C—P | 187 | 305 | P═O | 138 | 585 |
| C—S | 182 | 272 | P—P | - | 213 |
| C═S | 156 | 536 | Pb—O | 192 | 382 |
| C═S(CS2) | - | 577 | Pb—S | 239 | 346 |
| C—Si | 186 | 347 | Rb—Br | 294 | 381 |
| Cl—Cl | 199 | 243 | Rb—Cl | 279 | 428 |
| Cs—I | 337 | 337 | Rb—F | 227 | 494 |
| F—F | 140 | 153 | Rb—I | 318 | 319 |
| H—H | 75 | 436 | S—H | 135 | 339 |
| H—Br | 142 | 366 | S—O | - | 364 |
| H—Cl | 127 | 431 | S═O | 143 | - |
| H—F | 92 | 565 | S—S | 207 | 268 |
| H—I | 161 | 298 | S═S | 189 | - |
| I—I | 266 | 151 | Se—H | 147 | 314 |
| K—Br | 282 | 380 | Se—Se | 232 | - |
| K—Cl | 267 | 433 | Se═Se | 215 | - |
| K—F | 217 | 498 | Si—Cl | - | 360 |
| K—I | 305 | 325 | Si—F | - | 552 |
| Li—Cl | 202 | 469 | Si—H | - | 377 |
| Li—H | 239 | 238 | Si—O | - | 460 |
| Li—I | 238 | 345 | Si—Si | - | 176 |
