氯化反應
氯化反應
氯化反應一般指將氯元素引入化合物中的反應。在有機化學反應中,氯化反應一般包括置換氯化、加成氯化和氧化氯化;在冶金工業中,利用氯氣或氯化物提煉某些金屬也稱氯化;在水中投氯或含氯氧化物以達到氧化和消毒等目的的過程也稱為氯化。
chlorination;chloration
1、化合物的分子引入氯原子的反應。
有機化合物中,一般有置換氯化和加成氯化兩種類型。
置換氯化,如甲烷分子中的氫可被氯置換而成氯甲烷;在鐵催化劑存在下,苯中的氫被氯置換而生成氯代苯(氯苯)。
加成氯化,如苯在光的作用下與氯加成而生成六六六(六氯環己烷)。
2、在冶金工業中,利用氯氣或氯化物提煉某些金屬也稱氯化(見氯化冶金)。
3、在水中投氯或含氯氧化物以達到氧化和消毒等目的的過程。
氯化,即在化合物中引入氯元素生成含氯化合物。
加成氯化CH2= CH2 + Cl2→ClCH2CH2Cl
CH≡ CH + Cl2→CHCl = CHCl
取代氯化CH4 + Cl2→C H3 Cl + HCl
CH3 Cl + Cl2→C H2 Cl 2+ HCl
C6H6 + Cl2→C6 H5 Cl + HCl
氧氯化:在氯離子和氧原子存在下氯化,生成含氯化合物。
CuCl2
CH2= CH2 +2HCl + 0.5O2 ClCH2CH2Cl + H2O
C6H6 + HCl + 0.5O2 →C6 H5 Cl + H2O
熱氯化:熱能激發CL2,竭力成氯自由基,再與烴分子反應生成含氯化合物。
光氯化法:以光激發CL2,竭力成氯自由基,再與烴分子反應生成含氯化合物。常用UV作光源。在液相中進行,反應條件溫和。
催化氯化法:分均相催化和非均相催化。
CH2= CH2 + Cl2→ClCH2CH2Cl
CH≡ CH + HCl→CH2 = CHCl
CH2= CH2 +2HCl + 0.5O2→ClCH2CH2Cl + H2O
C6H6 + Cl2 →C6 H5 Cl + HCl
反應機理為自由基鏈鎖反應,產物為四種氯代甲烷的化合物,產物組成與T有關,主要決定於Cl2 / CH4 比例。工業生產方法
Cl2 / CH4=1:3~4
產物以CH3Cl 、 CH2Cl2為主
Cl2 太多,易發生爆炸反應
CH4 + Cl2 →C + HCl
烯烴的取代氯化與加成氯化
正構烯烴:低溫發生加成,高溫發生取代;
加成 取代
活化能 小 大
位阻 小 大
α-氫原子的異構烯烴,通常條件下只發生α-氫原子的取代氯化。只在低溫下才發生加成氯化。T起決定作用。氯/烯烴比例↑有利於加成氯化。
自由基鏈鎖反應機理。
丙烯熱氯化合成α-氯丙烯
主反應
CH3CH= CH2 + Cl2→ClCH2CH=CH2 + HCl-112.1kg/mol
副反應
ClCH2CH=CH2 + Cl2→ Cl2CHCH=CH2 + HCl
CH3CH= CH2 + Cl2→CH3CHClCH2Cl
CH3CH= CH2 + 3Cl2→3C + 6HCl
工藝條件
反應溫度:高溫有利於取代,500~510℃
原料配比
①採用大量過量的丙烯,反應易產生過熱現象,
導致丙烯的燃燒反應。
②大量丙烯循環,不經濟。 C3H6:Cl2=4~5:1
混合條件
混合后加熱—經歷一個加成反應階段
加熱后混合—易發生燃燒反應
工業上,丙烯(預熱200~400℃)
Cl2 (常溫)混合→反應
防止局部高溫,防止局部Cl2濃度高
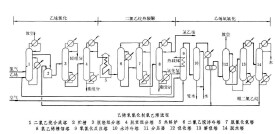
(1)乙烯制1,2-二氯乙烯
(2)乙炔氣相合成氯乙烯
氯乙烯合成方法:乙炔加HCl法
乙烯氧氯化法
CH≡ CH + HCl→CH2 = CHCl -124.8KJ/mol
工業催化劑
HgCl2/C
HgCl2含量↑,活性↑,10~20%
活性穩定性差
T<140℃, r慢
T>200 ℃, HgCl2大量升華,活性降低
溫控:160~180 ℃
HgCl2-BaCl2/C,穩定性較好
能耗大,Hg有毒
HCl的利用。
氯乙烯的生產方法(1)乙炔法
特點:技術成熟,流程簡單,副產物少,產品純度高,成本高,有污染。
(2)聯合法和烯炔法
以乙烯為原料合成氯乙烯:
乙烯與CL2加成 →1,2二氯乙烷(EDC);
EDC脫HCL→氯乙烯
聯合法省去乙烯和乙炔分離,但技術複雜,投資大,成本較高。
(3)平衡氧氯化法
此法的原料只需乙烯、氯和空氣,氯氣可全部利用平衡氧氯化法之三步反應:
H2C=CH2 + CL2 → CLH2C-CH2CL
H2C=CH2 + 2HCL + 1/2O2 → CLH2C-CH2CL + H2O
2CLH2C-CH2CL →2H2C=CHCL + 2HCL
總反應:H2C=CH2 + CL2 + 1/2O2 → 2H2C=CHCL + H2O