液液平衡
液液平衡
液液平衡是共存的幾個液相間的相平衡,常見的是兩個液相間的相平衡。液液平衡數據主要用於萃取計算中評選萃取劑和確定理論級數或傳質單元數。
目錄
共存的幾個液相間的相平衡,常見的是兩個液相間的相平衡。例如當水和苯共存時,水中溶有少量苯,苯中溶有少量水,兩者部分互溶,形成具有兩個液相的二元系。加入適量醋酸,醋酸既能溶於水相,又能溶於苯相,醋酸在水相與苯相中分配而達到平衡,系統仍保持兩個液相。至於多元系,可能有三個或更多液相共存,並達到平衡。液液平衡數據主要用於萃取計算中評選萃取劑和確定理論級數或傳質單元數。
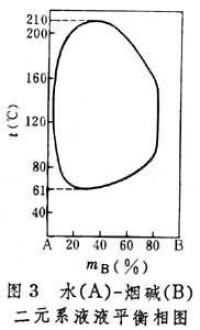
相圖 液液平衡關係可用相圖表述。水-異丁醇二元系的等壓相圖(圖1)表明: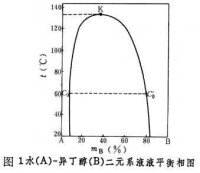 在一定溫度下,兩相區的包線上讀到的兩點和分別代表兩個共存液相的組成(以組分 B的表示)。這兩個共存液相又稱共軛相。一般來說,共軛相的組成通常隨溫度升高而相互接近,當溫度升高到K點的數值時,共軛相於點K會合,系統變成單相。這個會合點 K的溫度稱上部會溶溫度(也稱上部臨界溶解溫度)。溫度高於上部會溶溫度時,水和異丁醇完全互溶。但也有些系統,例如水-三乙胺二元系的共軛相組成隨溫度降低而相互接近(圖2),於是便有下部會溶溫度(也稱下部臨界溶解溫度),還有少數系統,如水-煙鹼二元系,既有上部會溶溫度,又有下部會溶溫度(圖3)。
在一定溫度下,兩相區的包線上讀到的兩點和分別代表兩個共存液相的組成(以組分 B的表示)。這兩個共存液相又稱共軛相。一般來說,共軛相的組成通常隨溫度升高而相互接近,當溫度升高到K點的數值時,共軛相於點K會合,系統變成單相。這個會合點 K的溫度稱上部會溶溫度(也稱上部臨界溶解溫度)。溫度高於上部會溶溫度時,水和異丁醇完全互溶。但也有些系統,例如水-三乙胺二元系的共軛相組成隨溫度降低而相互接近(圖2),於是便有下部會溶溫度(也稱下部臨界溶解溫度),還有少數系統,如水-煙鹼二元系,既有上部會溶溫度,又有下部會溶溫度(圖3)。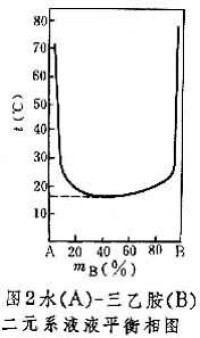
 相穩定性準則 由熱力學第二定律可得相穩定性準則:
相穩定性準則 由熱力學第二定律可得相穩定性準則:

液液平衡

液液平衡

液液平衡
式中為二元溶液的摩爾自由焓;為組分 1的摩爾分數。如果不滿足這一條件,則發生相分裂,形成兩個共存液相。在相平衡關聯中,並非每一種過量自由焓模型都能計算相分裂的條件。威爾遜方程是一個適用性較廣的過量自由焓模型,廣泛用於汽液平衡計算,由於不能滿足下列條件:
因而不能用於液液平衡計算。NRTL方程和 UNIQUAC方程能滿足這一條件,故可用於液液平衡計算。
分配係數 對於三元系的液液平衡,如上述的水-醋酸-苯三元系,溶質(醋酸)在兩個液相(苯相和水相)中的濃度比,稱為分配係數D:
式中α、β分別指兩個液相;為溶質i的濃度。如果溶質在兩相中形成理想溶液,則分配係數僅為溫度的函數;如果為非理想溶液,則分配係數還與溶液的組成有關。