共找到4條詞條名為H₂O的結果 展開
H₂O
水的化學公式
水(簡稱:一氧化二氫,化學式:H₂O)是由氫、氧兩種元素組成的無機物,無毒,可飲用。在常溫常壓下為無色無味的透明液體,被稱為人類生命的源泉。水可分為天然水(河流、湖泊、大氣水、海水、地下水等)[含雜質],蒸餾水[理論上的純凈水],人工制水(通過化學反應使氫氧原子結合得到的水)。水是地球上最常見的物質之一,是包括無機化合、人類在內所有生命生存的重要資源,也是生物體最重要的組成部分。水在生命演化中起到了重要作用。它是一種狹義不可再生,廣義可再生資源。
純水可以導電,但十分微弱(導電性在日常生活中可以忽略),屬於極弱的電解質。日常生活中的水由於溶解了其他電解質而有較多的正負離子,導電性增強。
目錄
水是包括無機化合、人類在內所有生命生存的重要資源,也是生物體最重要的組成部分。
水是地球上最常見的物質之一,地球有72%的表面被水覆蓋。水在空氣中含量雖少,但卻是空氣的重要組分。
純水導電性十分微弱,屬於極弱的電解質。日常生活中的水由於溶解了其他電解質而有較多的陰陽離子,才有較為明顯的導電性。
水是人體正常代謝所必需的物質,正常情況下身體每天要通過皮膚、內臟、肺以及腎臟排出1.5L左右的水,以保證毒素從體內排出。兒童體內有80%的水,老人體內則有50%~60%,正常中年人體內則有70%的水。
水——生命的源泉
水在機體內有許多重要功能:
(1)水是細胞原生質的重要組分;
(2)水在體內起溶媒作用,溶解多種電解質;
(3)水在體內起運輸作用,可以傳遞營養物質、代謝廢物和內分泌物質(如激素)等;
(4)水有較高熱導性和比熱,可作為“載熱體”在體內和皮膚表面間傳遞熱量,有助於人體調節體溫。
化學式D2O,又稱氧化氘。1931年H.C.尤萊在把4L液氫在-259℃下緩慢蒸發到剩餘數毫升,光譜分析時發現了重氫“D”,稱氘。氘(deuterium)的意思是2,表示原子量等於2的氫同位素。由重氫和氧組成的化合物稱重水,分子量為20.028,比普通水分子量18.016高出約11%。純重水在1933年就已製得。普通水中所含重水很少,約佔普通水質量的0.02%,自然界沒有富含重水的源泉。重水在外觀上和普通水相似,但許多物理性質不同,其比較見下表。
| 性質 | ||
| 相對密度(20℃) | 0.997 | 1.108 |
| 凝固點/℃ | 0.00 | 3.79 |
| 沸點/℃ | 100 | 101.41 |
| 蒸發熱/(kJ·mol-1) | 40.67 | 41.6 |
| 熔化熱/(kJ·mol-1) | 6.008 | 6.276 |
| 凝固點降低/℃0.997 | 1.86 | 2.00 |
重水分子間氫鍵力較大,分子間范德華力也較大,所以它的熔點、沸點比水高。常溫下重水的蒸氣壓比水小,這是水精餾法富集重水的理論根據。在25℃時重水的粘度比水大2.3%,致使許多電解質在重水中的電導率比水中小。重水的介電常數低於水,鹽類在重水中的溶解度一般小些,在25℃時1g水能溶解0.3592g氯化鈉,但1g重水只能溶解0.3056g;在25℃時,碘在四氯化碳和水間的分配係數是85:1,而在四氯化碳和重水間的分配係數是103:1。重水表面張力、離子積(2×10)數值都比水小,重水的反應速度比水的同樣反應要慢些。重水有吸水的性質,和濃硫酸相像,必須將它保存在密封的容器內。
重水的主要用途是在核反應堆中做“減速劑”,減小中子速度,控制核裂變過程,也是冷卻劑。重水和氘在研究化學和生理變化中是一種寶貴的示蹤材料,例如,用稀重水灌溉樹木,可以測知水在這些植物中每小時可運行十幾米到幾十米。測定飲過大量稀重水的人尿中的氘含量,知道水分子在人體中停留時間平均為14天。用氘代替普通氫,可以研究動植物消化和新陳代謝過程。濃的或純重水不能維持動植物生命,重水對一般動植物的致死濃度為60%。
生產重水的方法很多,曾用過電解法、水精餾法等,現在利用H2S/H2O雙溫交換法,先把重水富集約15%后,再電解富集成99.8%,該法成本低廉。

水
根據其化學式,人們又給水以下別稱:氧化氫、一氧化二氫;
類比VIA族與VIIA族其它化合物命名規律:氫氧酸、酸式氧;
類比金屬氫氧化物(鹼)命名規律:氫氧化氫、苛性氫、羥基氫、鹼式氫。
上述名稱雖各不相同,但描述的都是同一種物質——水。國外曾經有過一篇將水稱為"一氧化二氫"的惡搞文章,引起嘩然,就是人們對水的這些“另類命名”不了解造成的。
雖然可以根據水的化學式得到以上讀法,但是只有IUPAC規定的“水”與“氧烷”是正式名稱,其它名稱都不能在正式科學場合使用。在“水”的前面加上定語,可以用來區分特殊種類的水,比如蒸餾水、去離子水或重水。
正式命名:水、氧烷
民間命名:聚氫氧酸酐,苛性氫,脫氰零醛肟,一氧化二氫,氫化脫磺硫酸,羥基氫,脫碳甲醛,脫碳葡萄糖,脫羰甲酸,氧代硫化氫,氫氧化氫,鹼式氫,二氫醚,零醇,氫酚,氫羥酸,二零醚,正氧烷,氧乙烯,氫化超氧醯,二聚氫氧酸酐,氧化脫酯甲酸,氫化脫苄苯甲醇,羥基脫羧甲酸,氫化脫硝硝酸,氫化脫氰氰酸
地球是太陽系八大行星之中唯一被液態水覆蓋的星球。
地球上水的起源在學術界上存在很大的分歧,目前有幾十種不同的水形成學說。有些觀點認為在地球形成初期,原始大氣中的氫、氧化合成水,水蒸氣逐步凝結下來並形成海洋;也有觀點認為,形成地球的星雲物質中原先就存在水的成分。
當我們打開世界地圖時,或者當我們面對地球儀時,呈現在我們面前的大部分面積都是鮮艷的藍色。從太空中看地球,我們居住的地球是很圓的,因為地球的赤道半徑僅比兩極半徑長0.33%。地球是極為秀麗的蔚藍色球體。水是地球表面數量最多的天然物質,它覆蓋了地球71%以上的表面。地球是一個名副其實的大水球。
1.地球從原始星雲凝聚成行星后,由於內部溫度變化和重力作用,物質發生分異和對流,於是地球逐漸分化出圈層,在分化過程中,氫、氧氣體上浮到地表,再通過各種物理及化學作用生成水;
2.水是在玄武岩先熔化后冷卻形成原始地殼的時候產生的。最初地球是一個冰冷的球體。此後,由於存在地球內部的鈾、釷等放射性元素開始衰變,釋放出熱能。因此地球內部的物質也開始熔化,高熔點的物質下沉,易熔化的物質上升,從中分離出易揮發的物質:氮、氧、碳水化合物、硫和大量水蒸氣,試驗證明當1m花崗岩熔化時,可以釋放出26L的水和許多完全可揮發的化合物;

水
4.火山噴發釋放出大量的水。從現代火山活動情況看,幾乎每次火山噴發都有約75%以上的水汽會噴出。1906年維蘇威火山噴發的純水蒸氣柱高達13,000米,一直噴發了20個h。阿拉斯加卡特邁火山區的萬煙谷,有成千上萬個天然水蒸氣噴出孔,平均每秒種可噴出97~6450C的水蒸汽和熱水約23,000m。據此有人認為,在地球的全部歷史中,火山拋出來的固體物質總量為全部岩石圈的一半,火山噴出的水也可占現代全球大洋水的一半;
1.人們在研究球粒隕石成分時,發現其中含有一定量的水,一般為0.5~5%,有的高達10%以上,而碳質球粒隕石含水更多。球粒隕石是太陽系中最常見的一種隕石,大約佔所有隕石總數的86%。一般認為,球粒隕石是原始太陽最早期的凝結物,地球和太陽系的其他行星都是由這些球粒隕石凝聚而成的;
2.太陽風到達地球大氣圈上層,帶來大量的氫核、碳核、氧核等原子核,這些原子核與大氣圈中的電子結合成氫原子、碳原子、氧原子等。再通過不同的化學反應變成水分子,據估計,在地球大氣的高層,每年幾乎產生1.5t這種“宇宙水”。然後,這種水以雨、雪的形式落到地球上。
3.科學家在"深度撞擊號"在2005年1月13日撞擊了坦普爾1號彗星的彗核后在濺起的物質中發現了冰,兩-三億年前,由於木星與土星兩顆氣態巨行星在它們的兩星連珠時產生了巨大引力,奧爾特雲中的彗星被拉進了內太陽系中,地球也受到了彗星的撞擊,研究表明,大部分彗星是由宇宙塵埃、氣體、冰組成的,穀神星這一顆彗星中含有的水分比地球上所有的水還要多,彗星穿過大氣層時會融化為水,以雨、雪等形式落到地面上。
地球科學家傾向於認為,地球上的水來源於地球自身演化過程中的岩漿水等,天文學家更傾向於是彗星等撞擊地球帶來的水。目前兩種觀點誰都沒有說服誰。
很多人似乎覺得太空中的水很稀少,實際上水在太陽系中非常豐富。例如我們的臨近行星——火星,已經在其表面發現了很多乾涸的河床、湖泊、三角洲、沖積扇等,這說明火星表面曾經有大量的水。現在科學家也相信,火星地下和兩極可能藏有很多水。此外,一些小行星、海王星軌道之外的柯伊伯帶的天體上也有大量的水存在。而在柯伊伯帶以外的奧爾特雲更是分佈著大量的彗星,這些彗星大部分就由水組成。液態水能否存在的關鍵在於星球表面的溫度。在地球上,由於溫度通常在0℃~100℃之間,因此水才可能以液態形式存在。
有的星球如金星表面溫度達到400多攝氏度,遠遠超過了水的沸點,所以沒有液態水。有的星球如火星,表面溫度達到了零下四五十攝氏度,低於水的冰點,即使有水也都冰凍了,所以也不會有很多液態水。所以水出現在地球上並非偶然,而是必然現象。地球水的“第四種形態”地球上的水絕大多數其實並不是以我們所熟知的冰、水、氣三種形式存在。水還有另外一種存在形式,這種形式異乎尋常——那就是封存在岩石中的水。
可以說,這些岩石像一個巨大的水庫,它的含水量至少與地球上所有河流、海洋和冰川中的水量加起來一樣多,或許還是海洋水量的4倍、6倍或10倍。但它們一直被深埋在我們腳下410千米處。科學家把這種融入水的礦石稱為“水合礦物質”,即“水岩”。科學家認為,這種水岩遍布地下400千米~650千米的深處,厚達240千米,比地球表面的水層還要厚。即使這種礦石的含水量只有1%,其水量也很大,實際上已相當於地球海洋水量的幾倍。
水總硬度指的是水中鈣離子、鎂離子的總量,是衡量自來水是否符合標準的依據,主要可以分為暫時硬度和永久硬度兩大類。暫時硬度是指水中的鈣鎂離子以碳酸鹽的形式存在,遇熱就會形成碳酸鹽沉澱,最終被除去;而永久硬度則是指水中鈣鎂離子主要以硫酸鹽、硝酸鹽等形式存在,性質穩定,不易除去。
水硬度是評價水質的一個重要標準,對於飲用水以及工業用水有著很重要的影響。水硬度過高可能會形成水垢,影響產品質量。因此,為確定水質以及進行水的相關處理,要對水中鈣鎂離子進行測定,即水總硬度的測試。
水總硬度的監測分析是水質檢測的重要工作之一,不僅影響到水的質量,還會影響到人們生產以及生活的安全。在科技快速發展的今天,更多的檢測技術的應用,提高了水總質量檢測的準確性,保障了水質的安全以及使用質量。
(1)溶液pH值問題
測試中溶液的pH值在一定程度上會影響到金屬鈣鎂離子與EDTA生成絡合物的穩定性。pH過低,將會使絡合物的穩定性降低;pH過高,則水中鈣鎂離子將不能與EDTA反應。因此,在進行水總硬度測試之前必須要確定使用溶液的PH值,以保證實驗的順利進行。
(2)滴定溶液的溫度問題
水總硬度檢測時滴定溶液的溫度對檢測結果有著很大的影響,溫度過低就會造成反應速度過慢,滴定過量;溶液溫度過高就會使測試溶液中有效物質變質,影響鈣鎂離子與EDTA的反應過程。最終影響到水總硬度的檢測。
(3)緩衝溶液的問題
EDTA具有弱酸性,其反應過程受到溶液pH值的影響,因此,要將緩衝溶液加入到滴定溶液中,保持適合的pH值,保證測試的順利進行。
(4)鉻黑T的問題
鉻黑T是一種常見的金屬離子指示劑,用於滴定檢測過程中與鈣鎂離子進行置換作用,有明顯的顏色變化,可以準確的測出水的質量問題。鉻黑T指示劑的配製可以分為兩類,一類是固體指示劑,另一類則是液體指示劑。
(5)滴定時間及速度問題
水總硬度測試中,每次滴定必須要按照規定的零刻度開始,這樣可以保證讀數都在滴管的同一個位置上,減少讀數的誤差。在鹼性溶液中,鉻黑T會隨著時間的流逝而被氧化,影響最後反應結果。因此,要保證其在五分鐘之內完成反應,測出結果。但是,也要注意滴定的時候速度不要過快,否則可能導致溶液粘在滴定管壁上,影響讀數的誤差。
(6)溶液中二氧化碳的問題
溶液中可能含有碳酸氫根等物質,當其濃度過大時,就會使反應效果提前,影響測試結果。因此應該適當加入鹽酸,將其中和反應掉,使溶液呈現中性。還要注意,不要將滴定溶液放置時間過程,其極易與空氣中的二氧化碳反應,出現返紅現象。
水總硬度的檢測受到環境因素的影響,如果在滴定過程中發現沒有出現終點色,有可能是鐵離子、銅離子以及錳離子等的干擾,它們與指示劑形成更加穩定的絡合物,導致EDTA不能把金屬離子置換出來,就會影響水總質量的測定。
(1)鐵離子
在水總硬度測試中,鐵的含量過高,就會幹擾到測試的結果。相應的解決辦法就是要在加入緩衝溶液之前加入三乙醇胺,加快滴定速度,將鐵離子屏蔽。或者也可以利用沉澱過濾的方法來除去鐵離子,減少測試的誤差。
(2)銅離子
在水總質量的測試中,若是水樣中存在銅離子,將會出現指示劑封閉的現象,導致測試結果不清晰。相應的解決方法之一就是在加入緩衝溶液之前加入氰化鉀,使之與銅離子反應從而消除銅離子的干擾,但是要注意氰化鉀的劇毒性,盡量減少使用;另一種方法就是加入硫化鈉,也是使其與銅離子反應,形成硫化銅沉澱,將其過濾掉。
(3)鋁離子
若是水樣中存在鋁離子,在其作用下,可能會吸附指示劑,導致終點色出現時間延長,影響水硬度的測試。而解決辦法可以參考鐵離子的解決辦法,使水總硬度測試順利進行。
(4)水樣總鹼度
水總硬度檢測中,如果水樣滴定終點變藍,但是又很快的變回紫色,則證明水的鹼性很大,主要是由於鈣鎂離子造成的,相應的解決辦法就是可以在檢測之前將鹽酸酸化煮沸,可以去除一定的鹼性,之後需要將氫氧化鈉與之融合至中性,再繼續檢測將會發現滴定終點顏色變化會更明顯。
(5)有機物、懸浮物及膠狀物質
水總硬度檢測過程中如果發現水樣中有機物、懸浮物質過多,就會影響其終點顏色變化的觀察,影響到最終測試的結果。相應的解決辦法就是將著色物用乙醚去除掉,或者是用硝酸等進行溶解,在去除多餘的酸性,中和之後再進行水總硬度的檢測。
我國淡水資源總量較多,但按人口、耕地平均佔有水平很低與世界上許多國家相比,我國淡水資源問題比較嚴重,儘管我國河川徑流總量居世界第六位,但是由於我國國土遼闊,人口眾多,人均和畝均佔有量均低於世界平均水平。人均佔有量為世界人均佔有量的1/4左右,畝均佔有量僅為世界畝均佔有量的3/4。據對149個國家和地區的最新統計,中國人均佔有量已經退居世界110位。因此,正確處理好水及人和人及於水兩方面的關係比世界上任何一個國家都艱巨複雜。
我國淡水資源在地區上分佈不均,水土組合不平衡。我國的水量和徑流深的分佈總趨勢是由東南沿海向西北內陸遞減,並且與人口數耕地的分佈不相適應。81%集中分佈在長江及其以南地區,而耕地面積僅佔全國的36%;淮河及其以北地區耕地面積佔全國64%。
我國降水及河川的年內分配集中,年際變化大,連豐連枯年份比較突出。我國主要河流都出現過幾年來水較豐和幾年來水較枯現象。例如黃河在過去幾十年中曾出現過連續9年(1943~1951)的豐水期;在近幾十年內也曾出現過連續28年(1972~1999)的少水期,其中斷流21年。降水量和徑流量在時程上的這種劇烈變化,給淡水資源的利用帶來困難。要充分利用淡水資源勢必修建各種類型的水利。
淡水資源污染波及全國。如果從淡水資源人均佔有量上說,中國缺水主要是指北方區域的話,那麼,淡水資源的污染卻是一個具有全國性的問題。而且,越是豐水區和大城市,越是人口密集地區,往往污染越是嚴重。結果豐水區出現水質性缺水的現象。這是中國淡水資源更為嚴重的問題。
用水效率低和過度開發並存。首先是用水效率低,而且,越是缺水的地方,效率就越低。比如,嚴重缺水的黃河流域,農業灌溉大量採用的還是大漫灌方式。農業用水如此,工業用水也是如此。目前中國工業用水重複利用率遠低於先進國家75%的水平單位GDP用水量是先進國家的十幾倍到幾十倍,一些重要產品單位耗水量也比國外先進水平高几倍,甚至幾十倍。
對淡水資源過度開採的情況日趨嚴重。比如海河流域,海河流域是中國人口最密集的地區之一,包括北京、天津、河北大部分地區和山東、山西、內蒙、河南部分地區,區域內有26個大中城市。這個地區也是中國最為缺水的地區,人均只有293立方米。這些年來,這裡的社會經濟的狀況發生了很大變化。從20世紀80年代以來,中國的缺水現象由局部逐漸蔓延至全國,對農業和國民經濟帶來了嚴重影響。
中國鬧水荒,主要是指北方。特別是近20年來的自然變化和人類活動的影響,淡水資源南多北少的趨勢更加嚴重。這種由自然、地理、氣象等因素所形成的淡水資源分佈情況,單用軟科學的辦法是很難解決問題的。必須用硬辦法。正在進行中的南水北調工程,就是硬辦法之一。
優化資源配置主要包括兩個方面的內容,其一是解決我國水資源分佈不平衡,利用效率低的問題。當前我國政府已經採取了有效的措施,實現了水資源的優化配置。以南水北調工程為例,作為一項重大的戰略性工程,有效緩解了我國北方地區缺水嚴重的現象,不但實現了水資源的優化配置,還對區域經濟的良性發展產生了十分深遠的影響。其二是要合理分配地表水和地下水、一次性水資源和可再生水資源。政府要加強對分配后水資源的管理,通過市場的調節作用提高水資源利用率,避免水資源浪費。
長期以來,我國對水資源的利用採用了粗放式的模式,造成了水資源的大量浪費。以犧牲資源為目的的經濟發展模式雖然能夠在短時期內取得可觀的經濟效益,但從長遠發展來看無疑是慢性自殺,違背了我國可持續發展戰略的要求。在未來的發展中,我國將會在全社會提倡水資源的循環利用,並加快相關技術的研發,通過對廢水進行二次處理、重複利用達到提高水資源利用效率的目的,從而逐步打破水資源匱乏的發展態勢,為我國經濟社會的健康發展解決後顧之憂。
從目前的發展情況來看,水污染仍然是威脅我國水資源可持續發展的重要因素,在未來的發展中,水資源生態防治仍然是相關從業者的首要任務。水資源生態防治,不僅包括水污染治理,還包括提高環境用水承載能力、水資源保護、節約用水等多個方面。水資源生態防治是一個系統的工程,不僅需要專業人員的努力,還需要全社會的密切配合。比如,排污量大的工廠要自覺的進行技術改進,最大限度的控制工業用水的排放量。政府要加大監督管理制度,防止污水排放超出環境的承載能力;在全社會大力倡導節約用水,培養民眾節約用水的意識;做好水資源保護,防止人類生產生活用水對水資源造成破壞。
海水淡化又稱海水脫鹽,是從海水中獲取淡水的技術和過程。從海水中取出淡水或者除去海水中的鹽分,都可以達到淡化的目的。根據脫鹽過程分類,海水淡化方法主要有熱法、膜法和化學方法三大類。熱法海水淡化技術主要有多級閃蒸(MSF)、多效蒸餾(MED)、壓汽蒸餾(VC)和冷凍法。膜法海水淡化技術包含了反滲透(RO)和電滲析(ED),化學方法則由水合物法和離子交換法構成。在眾多海水淡化方法中,水合物法所產淡水水質較差,離子交換法制水成本較高,因此化學方法應用受到限制,而冷凍法海水淡化由於冰晶的洗滌和分離較困難,造成裝置複雜,運行可靠性不高,因而一直難以被大規模應用。目前,投入商業運行的海水淡化方法主要有多級閃蒸(MSF)、多效蒸餾(MED)、壓汽蒸餾(VC)、反滲透(RO)和電滲析(ED),世界上採用較多的海水淡化技術方法是多級閃蒸(MSF)、低溫多效蒸餾(LT-MED)和反滲透(RO)。
(1)多級閃蒸的原理
所謂閃蒸,是指一定溫度的海水在壓力突然降低的條件下,部分海水急驟蒸發的現象。多級閃蒸過程的原理是:將原料海水加熱到一定溫度后引入閃蒸室,由於該閃蒸室的壓力控制在低於熱鹽水溫度所對應的飽和蒸汽壓的條件下,故熱鹽水進入閃蒸室后即成為過熱水而急速的部分氣化,從而使熱鹽水自身的溫度降低,所產生的蒸汽冷凝后即為所需的淡水。多級閃蒸就是以此原理為基礎,使熱鹽水依次流經若干個壓力逐漸降低的閃蒸室,逐級蒸發降溫,同時鹽水也逐級增濃,直到其溫度接近(但高於)天然海水溫度。
(2)多級閃蒸工藝
多級閃蒸系統主要設備有鹽水加熱器、多級閃蒸裝置熱回收段、排熱段、水前處理裝置、排不凝氣裝置真空系統、鹽水循環泵和進出水泵等。其工藝流程為:進料海水→排熱段閃蒸器→預處理(混凝、消毒、殺藻、軟化、除垢)→循環鹽水泵→熱回收段閃蒸器各級。從排熱段閃蒸器出來的一部分海水作為排熱水排回大海,一部分海水通過預處理器后與從各級閃蒸器出來的濃鹽水在循環鹽水泵驅動下在系統內循環。
(3)多級閃蒸工藝的優缺點
多級閃蒸技術利用熱能和電能,適合於可以利用熱源的場合,通常與火力發電廠聯合建設與運行。該技術具有工藝成熟,海水結垢傾向小、設備簡單可靠、易於大型化、操作彈性大、運行安全性高以及可利用低位熱能和廢熱等優點。目前,多級閃蒸的總裝機容量在海水淡化領域仍屬第一。
主要缺點為設備材料費用較高,最高工作溫度可達到110℃,對材料要求高,腐蝕等問題較嚴重,除垢工作量大,調試工作量大,各級水位的調整比較麻煩,有泄漏會使成品水受到污染,如水質不滿足要求則需要強迫停機處理等。
(1)低溫多效蒸餾的原理
所謂低溫是指海水在第一效的最高蒸發溫度(鹽水頂溫)不高於70℃,這是因為當蒸發溫度低於70℃時,蒸發表面海水中鹽類結晶的速率將大大降低,從而可避免或減緩設備結垢的產生。
多效蒸餾是指:在第一效,海水經過蒸發器上部的噴嘴在管束外表面噴淋。鹽水從每一排管子向更低一排落下在每根管上形成降膜。加熱蒸汽通過管內時,溫度略微高一點的蒸汽在管內凝結,而鹽水在管外蒸發生成二次蒸汽。前一個蒸發器蒸發出來的蒸汽作為下一蒸發器的熱源,並凝結成為淡水,依此類推,蒸發和凝結重複進行。在LT-MED過程中,蒸發器按系列式布置,確保熱水蒸發側的壓力可成功地維持在低值。在一個蒸發器中凝結蒸汽成倍增加,是多效蒸發過程的標誌。
(2)低溫多效蒸餾的工藝
首先,進料海水在冷凝器中被預熱和脫氣之後被分成兩股物流:一股物流作為冷卻水排回大海;另外一股物流變成蒸餾過程的進料液,加入阻垢劑后的料液被引入到蒸發器溫度最低的一組中。噴淋系統把料液分佈到各蒸發器的頂排管上,在自上而下流動的過程中,部分海水吸收管內冷凝蒸汽的潛熱而汽化。剩餘料液用泵打入到蒸發器效的下一組中,該組的操作溫度要比上一組高。在新的組中又重複了蒸發和噴淋過程。剩餘的料液接著往前打,在溫度最高的效組中以濃縮液的形式離開。
其次,生蒸汽輸入到溫度最高一效的蒸發管內部。在管內冷凝的同時,在管外產生了基本等量的蒸發。二次蒸汽穿過捕沫裝置后,進入下一效傳熱管內,第二效的操作溫度和壓力要略低於第一效。這種蒸發和冷凝過程沿著一串蒸發器的各效重複,最後一效的蒸汽在冷凝器內被海水冷卻液冷凝。第一效的冷凝液被收集起來,該蒸餾水的一部分又返回到蒸汽發生器中,超過輸入的生蒸汽量的部分流入到一系列特殊容器的首個容器中,每一個容器都連接到下一低溫效的冷凝側。這樣使一部分蒸餾水產生閃蒸並使剩餘的產品水冷卻下來,同時,把熱量傳回蒸發器。
最後,產品水呈階梯狀流動並逐級閃蒸冷卻,放出的熱量提高了系統的總效率。被冷卻的蒸餾水最後用產品水泵抽出並輸入儲罐,生產出的產品水是平均含鹽量小於5mg/L的純水。濃縮海水像蒸餾水一樣,從第一效呈階梯狀流入一系列的濃鹽水閃蒸罐中,閃蒸冷卻以回收其熱量。經過冷卻之後,濃鹽水排回大海。不凝性氣體從冷凝管中抽出,並從一效流到另一效。這些不凝性氣體最後在冷凝器富集,並用蒸汽噴射器或機械式真空泵抽出。
(3)低溫多效蒸餾工藝的優缺點
低溫多效蒸餾海水淡化系統由於具有操作溫度低,避免或減緩了設備的腐蝕和結垢;預處理簡單;系統操作彈性大;動力消耗小;熱效率高;系統操作安全、可靠;可利用電廠低品位的餘熱而極大的降低了造水成本等優點,因此,已經成為未來第二代海水淡化廠的主流技術。但主要缺點是鹽水蒸發溫度不能超過70℃,要進一步提高熱效率受到制約,同時蒸汽的比容較大,要求設備的體積也較大,即設備的投入要增加。
(1)反滲透的原理
反滲透法是以壓力差為推動力的淡化過程,就是在有鹽分的水中(如原水),施以比自然滲透壓力更大的壓力,使滲透向相反方向進行,把原水中的水分子壓到半透膜的另一邊,變成潔凈的水,從而達到除去水中鹽分的目的。溶質和溶劑在膜中的擴散服從菲克(Fick)定理。物質的滲透能力不僅取決於擴散係數,而且取決於其在膜中的溶解度。溶質的擴散係數比水的擴散係數小得越多,高壓下水在膜內的移動速度就越快,因此透過膜的水分子數量就比通過擴散而透過去的溶質數量更多。
(2)反滲透工藝
反滲透海水淡化系統由預處理、高壓泵、膜組件、后處理構成。預處理通常去除懸浮固體、調節pH、添加阻垢劑以控制碳酸鈣和硫酸鈣結垢等;高壓泵用於對進料海水加壓;膜組件的核心是半透膜,它截留溶解的鹽類,幾乎只允許水通過;后處理主要是進行穩定處理,包括pH調節和脫氣處理等。
(3)反滲透工藝的優缺點
反滲透工藝具有設備投資少、佔地面積小、能量消耗低、建設周期短等諸多優點,但其反滲透淡化也具有產水純度略低、預處理要求嚴格以及溫度降低產水量下降的不足。
多級閃蒸裝置單機容量最高,投資也最大,低溫多效蒸餾與反滲透法的造水成本相差不多,反滲透電耗較高,操作性較複雜其出水水質較差。但反滲透應用於市政供水具有較大優勢,幾乎所有用於市政供水的海水淡化系統均採用了該法。對於要求提供鍋爐補給水和工藝純水,具有低品位蒸汽或餘熱可利用的電力、石化等企業,低溫多效蒸餾可實現能源的高效利用,聯產後降低了淡化成本,具有一定的競爭優勢。
當我們把水的溫度和壓力升高到臨界點(溫度374.3℃,壓力22.05MPa)以上,水就會處於一種既不同於氣態也不同於液態和固態的流體狀態——超臨界狀態,此狀態下的水就稱為超臨界水(SCW)。
超臨界水具有可壓縮性,溫度或壓力的微小變化就會引起超臨界水的密度大大減小,在臨界點時,水的密度僅為0.326g/cm,典型的超臨界水氧化是在密度接近0.1g/cm時進行的。
超臨界水(SCW)的溶解能力主要取決於其的密度,密度增加,溶解能力增強;密度減小,溶解能力減弱,甚至喪失對溶質的溶解能力。因此,有可能藉助系統壓力和溫度的調節,在較寬的範圍內變動SCW的溶解能力,使其利於溶質的相轉移。下表列出了超臨界水與普通水的溶解度對比。
| 溶質 | 普通水 | 超臨界水 |
| 無機物 | 大部分易溶 | 不溶或微溶 |
| 有機物 | 大部分微溶或不溶 | 易溶 |
| 氣體 | 大部分微溶或不溶 | 易溶 |
介電常數隨密度的增加而增大,隨壓力的升高而增大,隨溫度的升高而減小。介電常數的變化引起超臨界水溶解能力的變化,有利於溶解一些低揮發性物質,相應溶質的溶解度可提高5~10個數量級,所以超臨界水的介電常數與常溫、常壓下極性有機物的介電常數相當。因為水的介電常數在高溫下很低,水很難屏蔽掉離子間的靜電勢能,因此溶解的離子以離子對的形式出現,在這種條件下,水表現得更像一種非極性溶劑。
一般情況下,氣體的黏度隨溫度的升高而增大,液體的黏度隨溫度的升高而減小。超臨界水的黏度約為2.98×10Pa·s,這使得超臨界水成為高流動性物質。液體熱導率隨溫度的升高略有減小,常溫、常壓下水的熱導率為0.598W/(m·K),臨界點時熱導率約為0.418W/(m·K),變化不是很大。
根據Stockes方程,水在密度較高的情況下,擴散係數與黏度存在反比關係。高溫、高壓下水的擴散係數與水的黏度、密度有關。對高密度水,擴散係數隨壓力的增加而增加,隨溫度的增加而減小;對低密度水,擴散係數隨壓力的增加而減小,隨溫度的增加而增加,並且在超臨界區內,水的擴散係數出現最小值。超臨界水分子的擴散係數比普通水高10~100倍,使它的運動速度和分離過程的傳質速率大幅度提高,因而有較好的流動性、滲透性和傳遞性能,利於傳質和熱交換。
水的離子積對數與密度和溫度有關,但密度對其影響更大。離子積對數與密度和溫度的關係,密度越高,水的離子積對數越大。標準條件下水的離子積對數是10。在超臨界點附近,由於溫度升高使水的密度迅速下降,導致離子積對數減小;而在遠離臨界點時,溫度對密度的影響較小,溫度升高,離子積對數增大,因此,在溫度為1000℃、密度1g/cm時,水將是高度導電的電解質溶液。
超臨界水氧化技術(supercritical water oxidation)是由美國學者Modell在20世紀80年代中期提出的一種新型高級氧化水處理技術。它是以水為介質,在超臨界條件下的自由基反應,不存在氣液界面傳質阻力,可以提高反應速率並實現完全氧化。同焚燒、濕式催化氧化等技術相比,超臨界水氧化法具有良好的溶劑性能和傳遞性能,能徹底破壞有機污染物結構具有污染物完全氧化、二次污染小、設備與運行費用相對較低等優勢,是一種高效的環境友好型處理技術。
Modell在MODAR公司開發超臨界水氧化處理工藝;而從1990年開始,Gloyna開發研究超臨界水氧化處理工藝,並於1994年5月開始進行工業廢水處理研究。1996年,MODAR公司被General Atomics(GA)收購,General Atomics(GA)利用此技術處理軍工廢物。
我國從20世紀90年代中期開始從事近(超)臨界水氧化處理廢水廢液的研究,從剛開始小型設備的模擬廢水實驗到發展成為中型設備,同時開始了對高濃度的工業廢水處理,如炸藥廢水、印染廢水等都取得了非常好的處理效果,但是在工程應用方面還剛剛起步。在國內關於超臨界設備的專利已經很多,但由於它的高成本、易腐蝕、鹽沉積等原因,目前還難以實現工業化的大規模連續運行。
作為一種新興的高級氧化技術,超臨界水氧化技術具有相當的優越性。它可以徹底破壞有機物的結構,理論上可以適用於任何含有機物的廢物,在環保方面主要應用於處理高濃度的有機有毒難降解廢棄物。
(1)常規廢水領域
廢水中含有的有毒有害的污染物越來越多,成分複雜,危害大,許多污染物難以生化降解,運用超臨界水氧化技術可以使廢水中有毒有害的有機物開環、斷鍵、取代、電子轉移等,轉化成為易降解的小分子物質,甚至可以直接轉換成為水和二氧化碳,達到處理的目的。
SCWO(超臨界水氧化)反應速度快、氧化分解徹底。一般只需幾秒至幾分鐘即便可將廢水中的有機物徹底氧化分解,去除率可達99%以上。因此在處理廢水領域超臨界有著生化法不可替代的作用。
(2)高濃度有機廢液
含有高濃度的氨態氮、苯酚和化學需氧量(COD)的廢水可以很容易的在超臨界氧化過程中被破壞分解。並且超臨界水氧化技術在處理高濃度的有機廢液時,通常情況下,廢水中的有機物濃度>2%時,其自身反應放出的熱便可維持反應過程的熱平衡,從而實現自熱反應,進一步節約了能源。因此SCWO技術特別適合於高濃度難降解有機廢水的處理。
(3)固廢(含污泥)
固體廢物以及廢水處理過程中產生的污泥,除富含脂肪、蛋白質、纖維素和糖類等有機物外,還含有多種有毒有害的有機污染物和重金屬離子。其成分複雜,分析處理困難。傳統的處理方法主要為填埋法。但是存在處理效果不好,易產生二次污染等問題。超臨界水氧化技術的應用,不但使有害廢物處理效果更加顯著,並且降低了成本。在溫度為370~650℃,壓力為22~26MPa條件下,污泥處理率達到99%以上,最終產物為二氧化碳和水。
美國的超臨界水氧化技術發展較快,已經建成了大規模的工業化裝置,並且取得了非常好的處理效果及經濟效益。早在1994年,由美國MODEC公司為德國醫藥聯合體設計的SCWO(超臨界水氧化)工廠每天可處理5~30t有機物。
1995年,在美國的Austin市建成了一套可處理多種長鏈有機物和胺類的SCWO裝置。日本在超臨界水研究方面也早已進入了中試階段,1997年,日本三菱重工業公司和東北電力公司合建成一組處理廢塑料的中試裝置,處理能力為500kg/d。日本神鋼的超臨界水氧化系統於1997年引進美國技術,並與瑞典合作開發,於2000年建成,最大處理量為1.1t/h。瑞典於1999年建成處理能力為5.7m/d的SCWO水處理裝置。德國Daimler Chrysler公司建成了專門處理電子廢物的SCWO裝置。
國內的三門峽高清環保科技有限公司從1998年開始從事超臨界水氧化處理廢水的研究,對多種化工廢水進行小試,目前中試裝置為300L/d。國內有公司開發了一套專門處理高濃度化工廢液的超臨界連續裝置,處理水量達900~1000L/d。目前國內最大的生產規模日處理量為3.6t。
(1)腐蝕問題
SCWO(超臨界水氧化)的操作條件非常苛刻,高溫高壓以及極端pH值(pH=12),導致設備極易腐蝕。有研究表明,腐蝕SCWO不鏽鋼反應器的主要原因是高溫和氧化劑。在處理含鹵素、硫或磷的有機物時產生的酸會造成反應器的嚴重腐蝕。而強鹼性(pH>12)水溶液在超臨界溫度和氧化條件下對鎳質合金具有高的腐蝕性。
對SCWO工藝中產生的酸性產物,至少存在一種材料能適應其腐蝕性,但這種材料對其他酸卻沒有抗腐能力。因此,通過選擇和分離原料或針對不同的原料在反應器的不同部位應用不同的材料,可使腐蝕降到最低的程度。在水的臨界點附近,合金的腐蝕速率與溫度升成指數關係,溫度升高,腐蝕速率增大,但當溫度超過臨界溫度時,腐蝕速率隨著溫度的升高而降低。因此開發高性能耐高壓反應器材料,研究鎳基、鈦基的合金塗層及其他複合防腐塗層,反應器的優化設計等是預防超臨界水氧化法腐蝕的重要途徑。
(2)鹽沉積問題
大多數鹽在常溫下溶解度較大,但在超臨界水中溶解度很低。當溫度達到超臨界狀態時,由於鹽的溶解度大幅度降低,有大量沉澱析出,沉積的鹽會引起反應器堵塞,導致設備無法正常運行。鹽沉積問題成為了超臨界水氧化法推廣應用的重要問題之一。
最好的克服堵塞問題的辦法是使廢水中的鹽濃度最低化。低濃度含鹽廢水可以成功地被特殊的反應器所處理,而高濃度含鹽廢水最好用其他方法處理,或者反應器前段預脫鹽處理,然後再進行SCWO反應。或者研究反應器本身集成脫鹽連續排渣系統,如將反應釜底部設計成漏斗形狀,安裝排鹽口,可以使鹽都沉積在底部,及時排鹽排渣。
同濕式氧化法和焚燒法相比,超臨界水氧化技術處理廢物運行成本低,佔地面積少,操作維修費較低,具有一定的工業應用價值。
而且該技術應用範圍廣,操作過程簡單,可以應用於多種有毒有害物質的處理;處理效率高並且徹底,在適當的溫度、壓力和較短的停留時間下,有機物能被完全氧化成二氧化碳、水、氮氣以及鹽類等無毒無害的小分子化合物,處理率達到99.99%以上;均相反應,反應速率快,停留時間短,平均停留時間小於1min。反應器結構簡潔,體積小,佔地面積小,節約成本;若被處理廢水中的有機物濃度>2%,就可以依靠氧化反應過程中自身產生熱量來維持反應所需的熱能,不需要外界供給熱量,節約了能源,若污染物濃度較高,反應能放出更多的氧化熱,熱能可以回收再利用。
眾所周知,水有三態,分別為:固態、液態、氣態。
但是水卻不止只有三態,還有:超臨界流體、超固體、超流體、費米子凝聚態、等離子態、
玻色-愛因斯坦凝聚態等等。

水
沸點:99.975℃(氣壓為一個標準大氣壓時,也就是101.325kPa)。
凝固點:0℃
三相點:0.01℃
最大相對密度時的溫度:3.982℃
比熱容:4.186kJ/(kg·℃)0.1MPa15℃蒸發潛熱:2257.2kJ/(kg)0.1MPa100℃
密度:水的密度在3.98℃時最大,為1×10kg/m,水在0℃時,密度為0.99987×10kg/m,冰在0℃時,密度為0.9167×10kg/m。
臨界溫度:374.2℃
導熱率:在20℃時,水的熱導率為0.006J/s·cm·K,
冰的熱導率為0.023J/s·cm·K,
在雪的密度為0.1×10kg/m時,雪的熱導率為0.00029J/s·cm·K。
浮力分類:懸浮、漂浮、沉底、上浮、下沉。
不同溫度下水的各類物理參數:
| t | p | c | λ | a |
| 溫度 | 壓力 | 比熱容 | 導熱係數 | 熱擴散率 |
| ℃ | kPa | kJ/(kg·K) | W/(m·K) | 10m/h |
| 0.613 | 4.2077 | 0.558 | 4.8 | |
| 10 | 1.227 | 4.1910 | 0.563 | 4.9 |
| 20 | 2.333 | 4.1826 | 0.593 | 5.1 |
| 30 | 4.240 | 4.1784 | 0.611 | 5.3 |
| 40 | 7.373 | 4.1784 | 0.623 | 5.4 |
| 50 | 12.332 | 4.1826 | 0.642 | 5.6 |
| 60 | 19.918 | 4.1826 | 0.657 | 5.7 |
| 70 | 31.157 | 4.1910 | 0.666 | 5.9 |
| 80 | 47.343 | 4.1952 | 0.670 | 6.0 |
| 90 | 70.101 | 4.2077 | 0.680 | 6.1 |
| 100 | 101.325 | 4.2161 | 0.683 | 6.1 |
| 110 | 143 | 4.2287 | 0.685 | 6.1 |
| 120 | 198 | 4.2454 | 0.686 | 6.2 |
| 130 | 270 | 4.2663 | 0.686 | 6.2 |
| 140 | 361 | 4.2915 | 0.685 | 6.2 |
| 150 | 476 | 4.3208 | 0.684 | 6.2 |
| 160 | 618 | 4.3543 | 0.683 | 6.2 |
| 170 | 792 | 4.3878 | 0.679 | 6.2 |
| 180 | 1003 | 4.4254 | 0.675 | 6.2 |
| 190 | 1255 | 4.4631 | 0.670 | 6.2 |
| 200 | 1555 | 4.5134 | 0.663 | 6.1 |
| 210 | 1908 | 4.6055 | 0.655 | 6.0 |
| 220 | 2320 | 4.6473 | 0.645 | 6.0 |
| 230 | 2798 | 4.6892 | 0.637 | 6.0 |
| 240 | 3348 | 4.7311 | 0.628 | 5.9 |
水密度的變化

水
| 溫度(攝氏度) | 密度() |
| -30 | 983.854 |
| -20 | 993.547 |
| -10 | 998.117 |
| 999.8395 | |
| 4 | 999.9720 |
| 10 | 999.7026 |
| 15 | 999.1026 |
| 20 | 998.2071 |
| 22 | 997.7735 |
| 25 | 997.0479 |
| 30 | 995.6502 |
| 40 | 992.2 |
| 60 | 983.2 |
| 80 | 971.8 |
| 100 | 958.4 |
| 備註:低於0攝氏度的為過冷的水,別的皆為1標準大氣壓下的數值 | |
原因:主要由分子排列決定。也可以說由氫鍵導致。由於水分子有很強的極性,能通過氫鍵結合成締合分子。液態水,除含有簡單的水分子()外,同時還含有締合分子和等,當溫度在0℃水未結冰時,大多數水分子是以的締合分子存在,當溫度升高到3.98℃(101.325kPa)時水分子多以締合分子形式存在,分子佔據空間相對減小,此時水的密度最大。如果溫度再繼續升高在3.982℃以上,一般物質熱脹冷縮的規律即佔主導地位了。水溫降到0℃時,水結成冰,水結冰時幾乎全部分子締合在一起成為一個巨大的締合分子,在冰中水分子的排布是每一個氧原子有四個氫原子為近鄰兩個氫鍵這種排布導致成是種敞開結構,冰的結構中有較大的空隙,所以冰的密度反比同溫度的水小。
化學式:H₂O

水之韻律
相對分子質量:18.016
化學實驗:水的電解。方程式:2H₂O=通電=2H₂↑+O₂↑(分解反應)
分子構成:氫原子、氧原子。
CAS號:7732-18-5
水具有以下化學性質:
1.穩定性:在2000℃以上才開始分解。
水的電離:純水中存在下列電離平衡:H₂O==可逆==H⁺+OH⁻或H₂O+H₂O=可逆=H₃O⁺+OH⁻。
註:“H₃O⁺”為水合氫離子,為了簡便,常常簡寫成H⁺,更準確的說法為HO⁺,純水中氫離子物質的量濃度為10⁻⁷mol/L。
2.水的氧化性:水跟較活潑金屬或碳反應時,表現氧化性,氫被還原成氫氣。
2Na+2H₂O=2NaOH+H₂↑
Mg+2H₂O=Mg(OH)₂↓+H₂↑
3Fe+4H₂O(水蒸氣)=Fe₃O₄+4H₂(加熱)
C+H₂O=CO+H₂(高溫)
3.水的還原性:水跟氟單質反應時,表現還原性,氧被還原成氧氣
2F₂+2H₂O=4HF+O₂↑。
4.水的電解:
水在直流電作用下,分解生成氫氣和氧氣,工業上用此法制純氫和純氧2H₂O=2H₂↑+O₂↑。
5.水化反應:
水可跟活潑金屬的鹼性氧化物、大多數酸性氧化物以及某些不飽和烴發生水化反應。
Na₂O+H₂O=2NaOH
CaO+H₂O=Ca(OH)₂
SO₃+H₂O=H₂SO₄
P₂O₅+3H₂O=2H₃PO₄
CH₂=CH₂+H₂O←→C₂H₅OH
6.水解反應
鹽的水解:
氮化物水解:Mg₃N₂+6H₂O(加熱)=3Mg(OH)₂↓+2NH₃↑
NaAlO₂+HCI+H₂O=Al(OH)₃↓+NaCI(NaCI少量)
碳化鈣水解:CaC₂(電石)+2H₂O(飽和氯化鈉)=Ca(OH)₂+C₂H₂↑
鹵代烴水解:C₂H₅Br+H₂O(加熱下的氫氧化鈉溶液)←→C₂H₅OH+HBr
醇鈉水解:
C₂H₅ONa+H₂O→C₂H₅OH+NaOH
酯類水解:
CH₃COOC₂H₅+H₂O(銅或銀催化並且加熱)←→CH₃COOH+C₂H₅OH
多糖水解:(C₆H₁₀O₅)n+nH₂O←→nC₆H₁₂O₆
丙腈水解:CH₃CH₂CN+H₂O→CH₃CH₂C(OH)NH
CH₃CH₂C(OH)NH+H₂O→CH₃CH₂C(OH)₂NH₂→
CH₃CH₂CONH₂+H₂O→CH₃CH₂COOH+NH₃
醯胺水解:—CO—NH—+H₂O→—COOH+NH₂—
6.水分子的直徑數量級為10¹⁰,一般認為水的直徑為2~3個此單位。

水
純水有極微弱的導電能力,因為水有微弱的電離,存在著水的解離平衡。
H₂O←→H⁺+OH⁻
298.15K(即:25℃)時純水的離子積為10。
8.水是兩性物質,既有氫離子(H⁺),也有氫氧根離子(OH⁻)。但純凈蒸餾水是中性的。
9.水的PH值:水在25℃下PH值為7(中性),隨著溫度的變化仍為中性。
日常生活中的水可分為軟水和硬水,溶有較多可溶性鈣、鎂和鐵鹽的水叫做硬水。水中含有的Ca,Mg等離子的總濃度稱為硬度。水的硬度的單位為mol·m或mmol·dm。根據水的硬度可以將水分類為:
| 硬度/(mmol·dm) | >4.5 | 3.0~4.5 | 1.5~3.0 | 0.5~1.5 | <0.5 |
| 名稱 | 極硬水 | 硬水 | 中硬水 | 軟水 | 極軟水 |
工業上也有其他定義:以1dm水中含有的MgO與CaO總量相當於10mg的CaO定義為硬度1°,硬度在8°以上的為硬水。
含有HCO的水稱為暫時硬水,加熱時碳酸氫根離子分解使得鈣鎂離子沉澱而軟化。
含有Cl,SO的水不能通過加熱軟化,稱為永久硬水。
可以用肥皂水來區分軟硬度,煮沸可以使硬水變軟
地下水與地表水
地下水——有機物和微生物污染較少,而離子則溶解較多,通常硬度較高,蒸餾燒水時易結水垢;有時錳氟離子超標,不能滿足生產生活用水需求。
地表水——較地下水有機物和微生物污染較多,如果該地屬石灰岩地區,其地表水往往也有較大的硬度,如四川的德陽、綿陽、廣元、阿壩等地區。
原水與凈水
原水——通常是指水處理設備的進水,如常用的城市自來水、城郊地下水、野外地表水等,常以TDS值(水中溶解性總固體含量)檢測其水質,中國城市自來水TDS值通常為100~400ppm。
凈水——原水經過水處理設施處理后即稱之為凈水。
純凈水與蒸餾水
純凈水——原水經過反滲透和殺菌裝置等成套水處理設施后,除去了原水中絕大部分無機鹽離子、微生物和有機物雜質,可以直接生飲的純水。
蒸餾水——以蒸餾方式製備的純水,通常不用於飲用。
純化水和注射用水
純化水——醫藥行業用純水,電導率要求<2μs/cm。
注射用水——純化水經多效蒸餾、超濾法再次提純去除熱原后可以配製注射劑的水。
自由水和結合水
自由水——又稱體相水,滯留水。指在生物體內或細胞內可以自由流動的水,是良好的溶劑和運輸工具。水在細胞中以自由水與束縛水(結合水)兩種狀態存在,由於存在狀態不同,其特性也不同。自由水佔總含水量的比例越大,使原生質的粘度越小,且呈溶膠狀態,代謝也愈旺盛。
結合水——是水在生物體和細胞內的存在狀態之一,是吸附和結合在有機固體物質上的水,主要是依靠氫鍵與蛋白質的極性基(羧基和氨基)相結合形成的水膠體。
尋找地下水源的首選之地就是地表早已乾枯的溪流與河流的河床地區。雖然這些地方的地表早已無水,但是在它們的地表下往往能找到豐富的地下水。
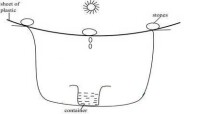
日光蒸餾法
太陽的照射使坑內潮濕土壤和空氣的溫度升高,蒸發產生水汽。水汽逐漸飽和,與塑料膜接觸遇冷凝結成水珠,下滑至水壺中,這種方法在一天之內能收集大約半升水。
通過凝結植物的水汽來收集水分。在一段健壯枝葉濃密的樹木嫩枝上套一個塑料袋,放袋子的時候要注意使袋口朝上,袋的一角向下,這樣便於接收葉面蒸騰作用產生的凝結水。因為蒸騰作用產生的水汽上升與薄膜接觸時遇冷后就會凝結成水滴。應讓凝結的水珠沿著薄膜內壁流入底部收集器中。
(一)沉澱物過濾法
(二)硬水軟化法
(三)活性炭吸附法
(四)去離子法
(五)逆滲透法、反滲透法
(六)超過濾法
(七)蒸餾法
(八)紫外線消毒法
(九)生物化學法
(十)正向滲透法,自然凈化方法的人類新創造。
“滲透”在海水淡化、脫鹽、水處理領域,啰嗦、複雜一下又稱正滲透、或正向滲透,以示與反滲透、反向滲透法、逆滲透的差異、區別或對應、強調,正向滲透法是與反滲透互逆的一對方法。正滲透作為一種潛在的水純化和淡化新技術,世界上正對其進行著多角度、深層次的理論研究和實踐探索。
隨著科技的飛速發展,壓力驅動反滲透膜分離技術(RO)在膜、膜組器、設備和工藝等方面都有了較大創新和改進,但人們也越來越意識到RO技術在節能、環保領域存在的局限,而且就脫鹽來講,RO技術可認為已接近發展的頂峰。因此,國外已經開展了“正向滲透膜分離技術(FO)”的相關研究,並取得了一定的成果,在海水淡化、污水處理、食品加工、醫藥等領域得到了應用,特別是“壓力延緩滲透(FRO)海水發電”,更是一項極具前景的清潔再生能源開發技術。但是國內對正向滲透膜分離技術關注得很少,相關研究和論文也不多。雖然,上個世紀90年代我國有了創造性的發明“非加壓吸附滲透法海水淡化”(CN92110710。2)。
國外1976年,有液-液體系的原始嘗試,國內1992年,發明過液-固體系的正向滲透(非加壓)吸附滲透法脫鹽(CN92110710。2)。直到約10年後,又重新跟隨國際潮流,開始標準的模仿複製的模式,2008年開始有綜述報告。
正向滲透分離技術很早就得到了應用。很久以前,人們就採用食鹽來長期貯存食物,因為在高鹽環境下多數細菌、黴菌和病原菌由於滲透作用會脫水死亡或暫時失去活性。
如今,人們已經開始利用正向滲透膜分離技術進行海水淡化、工業廢水處理、垃圾滲透液處理等研究;食品工業在實驗室利用正向滲透膜分離來濃縮飲料;緊急救援時的生命支持系統利用正向滲透膜分離技術製取淡水。隨著材料科學的發展,正向滲透技術已經應用於人體的藥物控制釋放。
薄膜的孔用引導水分子通過活細胞的細胞膜的蛋白質來構成。
水對氣候具有調節作用。大氣中的水汽能阻擋地球輻射量的60%,保護地球不致於被冷卻。海洋和陸地水體在夏季能吸收和積累熱量,使氣溫不致過高;在冬季則能緩慢地釋放熱量,使氣溫不致過低。
海洋和地表中的水蒸發到天空中形成了雲,雲中的水分子在達到一定數量時通過降水落下來變成雨,冬天則變成雪。落於地表上的水滲入地下形成地下水;地下水又從地層里冒出來,形成泉水,經過小溪、江河匯入大海。形成一個水循環[註:植物也參與了水循環]。
雨雪等降水活動對氣候形成重要的影響。在溫帶季風性氣候中,夏季風帶來了豐富的水氣,夏秋多雨,冬春少雨,形成明顯的乾濕兩季。
此外,在自然界中,由於不同的氣候條件,水還會以冰雹、霧、露水、霜等形態出現並影響氣候和人類的活動。
在地球表面有71%被水資源覆蓋,從空中來看,地球就是個藍色的星球。水侵蝕岩石土壤,沖淤河道,搬運泥沙,營造平原,改變地表形態。
地球表層水體構成了水圈,包括濕地、海洋、河流、湖泊、沼澤、冰川、積雪、地下水和大氣中的水。由於注入海洋的水帶有一定的鹽分,加上常年的積累和蒸發作用,海水和大洋里的水都是鹹水,不能被直接飲用。某些湖泊的水也是含鹽水,比如:死海。世界上最大的水體是太平洋。北美的五大湖是最大的淡水水系。歐亞大陸上的裏海是最大的鹹水湖。
地球上水的體積大約有1,360,000,000立方公里。海洋佔了1,320,000,000立方公里(97.2%);冰川和冰蓋佔了25,000,000立方公里(1.8%);地下水佔了13,000,000立方公里(0.9%);湖泊、內陸海,和河裡的淡水佔了250,000立方公里(0.02%);大氣中的水蒸氣在任何已知的時候都佔了13,000立方公里(0.001%)。
雨水的藥用功能
雨水,又名無根水,中醫認為其性輕清,味甘淡,諸水之上也。夏日尤佳。飲之可以去病。(剛下的雨水中含有大量塵埃,特別在現代化的和工業污染嚴重的城市,成分相當複雜,甚至可能含有致病微生物。但在未受污染的地方,乾淨的雨水功能依舊)。

農業灌溉
2.古代亞述國王在其首都四周種滿珍稀植物。為了灌溉這些植物,他修了一條長長的運河,用來從附近的水源處引水灌溉這些植物。
3.在墨西哥前首都特諾奇幕特蘭四周有許多湖,阿茲泰克人在湖中建台田。他們挖出湖裡的淤泥鋪在田上,再種上作物。阿茲泰克人在台田周圍挖了溝渠,類似於中國的水田用於灌溉。
4.以色列位於沙漠之中,沙漠占國土面積的60%,不僅耕地少,而且是一個半乾旱地區,降雨量少,季節性強,區域分佈不均,淡水資源缺乏的問題極為突出,出於生存和發展的需要,一建國就制定法律,宣布水資源為公共財產,由專門機構進行管理。除興修水利外,還大力發展節水技術。農業生產中基本不用常見的漫灌、溝灌、畦灌方法。20世紀70年代末以前多採用噴灌,占灌溉面積的87%,滴灌佔10%。80年代后,滴灌開始普遍採用,本世紀初已佔灌溉面積的90%,主要用於蔬菜、水果、花卉、棉花等種植上。滴灌投資並不比噴灌高,不僅節水,而且對地形、土壤、環境的適應性強,不受風力和氣候影響,肥料和農藥可同時隨灌溉水施人根系,省肥省葯,還可防止產生次生鹽漬化,消除根區有害鹽分。滴灌技術的採用,使作物產量成倍增長,種植業產值的90%以上來自灌溉農業。
對於人來說,水是僅次於氧氣的重要物質。在成人體內,60~70%的質量是水。兒童體內水的比重更大,可達近80%。如果一個人不吃飯,僅依靠自己體內貯存的營養物質或消耗自體組織,可以活上一個月。但是如果不喝水,連一周時間也很難度過。體內失水10%就威脅健康,如失水20%,就有生命危險,足可見水對生命的重要意義。
水還有治療常見病的效果,比如:清晨一杯涼白開水可治療色斑;餐後半小時喝一些水,可以用來減肥;熱水的按摩作用是強效的安神劑,可以緩解失眠;大口大口地喝水可以緩解便秘;睡前一杯水對心臟有好處;噁心的時候可以用鹽水催吐。
1.溶解消化功能
水是體內一切生理過程中生物化學變化必不可少的介質。水具有很強的溶解能力和電離能力(水分子極性大),可使水溶性物質以溶解狀態和電解質離子狀態存在,甚至一些脂肪和蛋白質也能在適當條件下溶解於水中,構成乳濁液或膠體溶液。溶解或分散於水中的物質有利於體內化學反應的有效進行。
食物進入空腔和胃腸后,依靠消化器官分泌出的消化液,如唾液、胃液、胰液、腸液、膽汁等,才能進行食物消化和吸收。在這些消化液中水的含量高達90%以上。
2.參與代謝功能
在新陳代謝過程中,人體內物質交換和化學反應都是在水中進行的。水不僅是體內生化反應的介質,而且水本身也參與體內氧化、還原、合成、分解等化學反應。水是各種化學物質在體內正常代謝的保證。
如果人體長期缺水,代謝功能就會異常,會使代謝減緩從而堆積過多的能量和脂肪,使人肥胖。
3.載體運輸功能
由於水的溶解性好,流動性強,又包含於體內各個組織器官,水充當了體內各種營養物質的載體。在營養物質的運輸和吸收、氣體的運輸和交換、代謝產物的運輸與排泄中,水都是起著極其重要的作用。比如,運送氧氣、維生素、葡萄糖、氨基酸、酶、激素到全身;把尿素、尿酸等代謝廢物運往腎臟,隨尿液排出體外。
4.調節抑制功能
水的比熱高,對機體有調節體溫的作用。
防止中暑最好的辦法就是多喝水。這是因為認為攝入的三大產能營養素在水的參與下,利用氧氣進行氧化代謝,釋放能量,再通過水的蒸發可散發大量能量,避免體溫升高。當人體缺水時,多餘的能量就難以及時散出,從而引發中暑。
此外,水還能夠改善體液組織的循環,調節肌肉張力,並維持機體的滲透壓和酸鹼平衡。
5.潤滑滋潤功能
在缺水的情況下做運動是有風險的。因為組織器官缺少了水的潤滑,很容易造成磨損。因此,運動前的1個小時最好要先喝充足的水。
體內關節、韌帶、肌肉、膜等處的活動,都由水作為潤滑劑。水的黏度小,可使體內摩擦部位潤滑,減少體內臟器的摩擦,防止損傷,並可使器官運動靈活。
同時水還有滋潤功能,使身體細胞經常處於濕潤狀態,保持肌膚豐滿柔軟。定時定量補水,會讓皮膚特別水潤、飽滿、有彈性。可以說,水是美膚的佳品。
6.稀釋和排毒功能
不愛喝水的人往往容易長痘痘,這是因為人體排毒必須有水的參與。沒有足夠的水,毒素就難以有效排出,淤積在體內,就容易引發痘痘。
其實,水不僅有很好的溶解能力,而且有重要的稀釋功能,腎臟排泄水的同時可將體內代謝廢物、毒物及食入的多餘藥物等一併排出,減少腸道對毒素的吸收,防止有害物質在體內慢性蓄積而引發中毒。因此,服藥時應喝足夠的水,以利於有效地消除藥品帶來的副作用。
植物的生長需要水分,水(與二氧化碳)作為原料參與了光合作用,且在植物的呼吸作用中作為產物。
水的污染有兩類:一類是自然污染;另一類是人為污染。當前對水體危害較大的是人為污染。水污染可根據污染雜質的不同而主要分為化學性污染、物理性污染和生物性污染三大類:
一、化學性污染
污染雜質為化學物品而造成的水體污染。化學性污染根據具體污染雜質可分為6類:
(1)無機污染物質:污染水體的無機污染物質有酸、鹼和一些無機鹽類。酸鹼污染使水體的pH值發生變化,妨礙水體自凈作用,還會腐蝕船舶和水下建築物,影響漁業。
(2)無機有毒物質:污染水體的無機有毒物質主要是重金屬等有潛在長期影響的物質,主要有汞、鎘、鉛、砷等元素。
(3)有機有毒物質:污染水體的有機有毒物質主要是各種有機農藥、多環芳烴、芳香烴等。它們大多是人工合成的物質,化學性質很穩定,很難被生物所分解。
(4)需氧污染物質:生活污水和某些工業廢水中所含的碳水化合物、蛋白質、脂肪和酚、醇等有機物質可在微生物的作用下進行分解。在分解過程中需要大量氧氣,故稱之為需氧污染物質。
(5)植物營養物質:主要是生活與工業污水中的含氮、磷等植物營養物質,以及農田排水中殘餘的氮和磷。
(6)油類污染物質:主要指石油對水體的污染,尤其海洋採油和油輪事故污染最甚。
二、物理性污染
物理性污染包括:
(1)懸浮物質污染:懸浮物質是指水中含有的不溶性物質,包括固體物質和泡沫塑料等。它們是由生活污水、垃圾和採礦、採石、建築、食品加工、造紙等產生的廢物泄入水中或農田的水土流失所引起的。懸浮物質影響水體外觀,妨礙水中植物的光合作用,減少氧氣的溶入,對水生生物不利。
(2)熱污染:來自各種工業過程的冷卻水,若不採取措施,直接排入水體,可能引起水溫升高、溶解氧含量降低、水中存在的某些有毒物質的毒性增加等現象,從而危及魚類和水生生物的生長。
(3)放射性污染:由於原子能工業的發展,放射性礦藏的開採,核試驗和核電站的建立以及同位素在醫學、工業、研究等領域的應用,使放射性廢水、廢物顯著增加,造成一定的放射性污染。
三、生物性污染
生活污水,特別是醫院污水和某些工業廢水污染水體后,往往可以帶入一些病原微生物。例如某些原來存在於人畜腸道中的病原細菌,如傷寒、副傷寒、霍亂細菌等都可以通過人畜糞便的污染而進入水體,隨水流動而傳播。一些病毒,如肝炎病毒、腺病毒等也常在污染水中發現。某些寄生蟲病,如阿米巴痢疾、血吸蟲病、鉤端螺旋體病等也可通過水進行傳播。由此看見保護我們的地球環境,防止工業污染和病原微生物對水體的污染也是保護環境,更是保障人體健康的一大課題。
1.廢水流過沉澱槽,固狀物會沉澱下來。
2.在滴流過濾中,廢水流過沙礫得以過濾,沙礫表面也可鋪細菌,以分解污水中的廢物。
3.還可在水中加入漂白粉,氯氣等殺死微生物。
4.水被排入露天池塘,可以天然凈化。
5.廢水經過“旋水分離器”,能過濾。
石英砂過濾是去除水中懸浮物最有效手段之一,是污水深度處理、污水回用和給水處理中重要的單元。其作用是將水中已經絮凝的污染物進一步去除,它通過濾料的截留、沉降和吸附作用,達到凈水的目的。
二.適用範圍
1.用於要求出水濁度≤5mg/L能符合飲用水質標準的工業用水、生活用水及市政給水系統;
2.工業污水中的懸浮物、固體物的去除;
3.可用作離子交換法軟化、除鹽系統中的預處理設備,對水質要求不高的工業給水的粗過濾設備;
以及用在游泳池循環處理系統、冷卻循環水凈化系統等。
在文明的早期,人們開始探討世界各種事物的組成或者分類,水在其中扮演了重要角色。在人類的童年時期,由於科學水平低,對於水的認識不足,不能從科學角度解釋水的性質,對於水能滅火,能養育人類,但也可以淹溺,兼有養育與毀滅能力產生了又愛又怕的感情,產生了水崇拜,此種崇拜帶有迷信性質。
• 和水系之間的關係
一些地區,每年汛期,定期來訊,水量極大,這是水系表現,對於各個區域出現這樣的情況,應積極利用,挖庫擴容清淤,汛期蓄水,儲存淡水,涵養水源,表面看起來,總是山洪暴發、和汛期抗洪,沒有了解水系來水規律,來水就抗,水也沒存貯,結果是旱時無水,澇時不存。
易發山洪區域,應該積極開發水利存儲和庫容設施,自然改善生態,堅持實施,就會改善局部氣候環境,生態會持續向好,節省候補的經濟建設投入,形成良性循環生態動態平衡。
地球上水的總儲量為13.6億立方公里,我們通常說的水資源主要是陸地上的淡水資源,淡水只佔9%;其中有97%的淡水儲存在南、北極的冰川中。而對人類生活最密切的湖泊,河流和淺層地下的淡水僅占淡水總儲量的0.2%。
詳細見水系詞條。
• 冰

冰
水溶解時拆散了大量的氫鍵,使整體化為四面體集團和零星的較小的“水分子集團”(即由氫鍵締合形成的一些締合分子),故液態水已經不象冰那樣完全是有序排列了,而是有一定程度的無序排列,即水分子間的距離不象冰中那樣固定,H₂O分子可以由一個四面體的微晶進入另一微晶中去。這樣分子間的空隙減少,密度相對冰就會增大。
詳見冰詞條。
• 超臨界水
當氣壓和溫度達到一定值(約22MPa,374攝氏度)時,水達到超臨界狀態。體系溫度和壓力超過臨界點的水,稱為超臨界水。臨界點時水與水蒸氣不可區分,成為一種新的呈現高壓高溫狀態的流體。這種超臨界流體有很多性質,比如具有極強的氧化能力,將需要處理的物質放入超臨界水中,再向其中溶解氧氣(可以大量溶解),其氧化性強於高錳酸鉀。二是許多物質都可以在其中燃燒,冒出火焰。三是可以溶解很多物質(比如油),且在溶解時體積會大大縮小,這是因為超臨界水在這時會緊緊裹住油。四是它能夠緩慢地溶解腐蝕幾乎所有金屬,甚至包括黃金(與王水相仿)。五是它的超級催化作用,在超臨界水中,化學反應變得很快。
詳見超臨界水詞條。
• 重水與輕水
重水(heavy water、deuteroxide )(氧化氘)是由氘和氧組成的化合物。分子式D₂O,分子量20.0275,比普通水(H₂O)的分子量18.0153高出約11%,因此叫做重水。在天然水中,重水的含量約佔0.015%。由於氘與氫的性質差別極小,因此重水和普通水也很相似。重水的離子積常數為1.6*10-15。
為了與重水區別,將普通水稱為輕水。動力堆中的慢化劑,大多是輕水、重水和石墨;它們的冷卻劑,則多是輕水、重水和氦等氣體。唯有輕水是目前各種反應堆中用得最廣的慢化劑和冷卻劑。
詳細見重水和輕水詞條
