氫原子
氫元素的原子
氫原子即氫元素的原子。氫原子模型是電中性的,原子含有一個正價的質子與一個負價的電子,他們被庫侖定律束縛於原子內。氫只有三種同位素:氕(P)原子核內有1個質子,無中子,丰度為99.98%;氘(D)(又叫重氫) ,原子核內有1個質子,1個中子,丰度0.016%;氚(T)(又叫超重氫),原子核內有1個質子,2個中子,丰度0.004%。
1913 年,尼爾斯·玻耳在做了一些簡化的假設后,計算出氫原子的光譜頻率。這些假想,玻爾模型的基石,並不是完全的正確,但是可以得到正確的能量答案。
1925/26 年,埃爾文·薛定諤應用他發明的薛定諤方程,以嚴謹的量子力學分析,清楚地解釋了玻爾答案正確的原因。氫原子的薛定諤方程的解答是一個解析解,也可以計算氫原子的能級與光譜譜線的頻率。薛定諤方程的解答比玻爾模型更為精確,能夠得到許多電子量子態的波函數(軌道),也能夠解釋化學鍵的各向異性。
氫原子是氫元素的原子。電中性的原子含有一個正價的質子與一個負價的電子,被庫侖定律束縛於原子核內。在大自然中,氫原子是丰度最高的同位素,稱為氫,氫-1,或氕。氫原子不含任何中子,別的氫同位素含有一個或多個中子。這條目主要描述氫-1 。
氫原子擁有一個質子和一個電子,是一個的簡單的二體系統。系統內的作用力只跟二體之間的距離有關,是反平方有心力,不需要將這反平方有心力二體系統再加理想化,簡單化。描述這系統的(非相對論性的)薛定諤方程有解析解,也就是說,解答能以有限數量的常見函數來表達。滿足這薛定諤方程的波函數可以完全地描述電子的量子行為。因此可以這樣說,在量子力學里,沒有比氫原子問題更簡單,更實用,而又有解析解的問題了。所推演出來的基本物理理論,又可以用簡單的實驗來核對。所以,氫原子問題是個很重要的問題。
另外,理論上薛定諤方程也可用於求解更複雜的原子與分子。但在大多數的案例中,皆無法獲得解析解,而必須藉用電腦(計算機)來進行計算與模擬,或者做一些簡化的假設,方能求得問題的解析解。
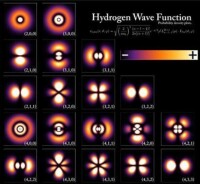
右圖顯示出能量最低的幾個氫原子軌道(能量本徵函數)。橫向展示不同的角量子數 (l) ,豎向展示不同的能級 (n)。
氫原子
基態是最低能級的量子態,也是電子最常找到的量子態,標記為1s態,, 。
特別注意,在每一個軌道的圖片內,黑線出現的次數。這些二維空間黑線,在三維空間里,是節面(nodal plane) 。節面的數量等於,是徑向節數與角節數的總和。
思考氫原子穩定性問題,應用經典電動力學來分析,則由於庫侖力作用,束縛電子會被原子核吸引,呈螺線運動掉入原子核,同時輻射出無窮大能量,因此原子不具有穩定性。但是,在大自然里這虛擬現象實際並不會發生。那麼,為什麼氫原子的束縛電子不會掉入原子核里?應用量子力學,可以計算出氫原子系統的基態能量大於某有限值,稱這結果為滿足“第一種穩定性條件”,即氫原子的基態能量大於某有限值:
量子力學的海森堡不確定性原理可以用來啟發性地說明這問題,電子越接近原子核,電子動能越大。但是海森堡不確定性原理不能嚴格給出數學證明,有些特別案例不能滿足第一種穩定性條件,因為量度的是波函數的半寬度,而不是波函數集聚於原子核附近的程度,所以波函數可以擁有一定的半寬度,並且極度集聚於原子核附近,造成庫侖勢能趨於,同時維持有限的動能。
更詳細分析起見,只考慮類氫原子系統,給定原子的原子序Z ,原子的能量 E為
其中,為動能,為勢能,為描述類氫原子系統的波函數, 為位置坐標,為積分體積。
應用索博列夫不等式,經過一番運算,可以得到能量最大下界為
其中, Ry是能量單位里德伯,大約為13.6eV。
總結,類氫原子滿足第一種穩定性條件這結果。
相鄰較輕同位素: (沒有, 最輕的) | 氫原子是 氫的同位素 | 相鄰較重同位素: 氫-2 |
母同位素: 自由中子 氦-2 | 氫原子的 衰變鏈 | 衰變產物為 (穩定) |
● 氘
● 氚
● 氫原子光譜
● 21公分線
● 量子化學
● 類氫原子
● 球對稱位勢
● 拉普拉斯-龍格-楞次矢量