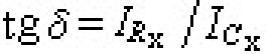光化學定律
光化學定律
光化學定律是由C.J.D.格羅特斯於1818年提出的。具體內容“被物質吸收的光,產生光化學變化”。
1818年C.J.D.格羅特斯等人曾提出光化學活化原則:只有被物質吸收的光,才能產生光化學變化。這就是光化學第一定律。因而,不僅應該知道反應的吸收光譜和光源的光譜能量分佈,而且也應了解光源與反應物間存在的溶劑、產物和玻璃製品的吸收光譜。
式中 I0為入射到單吸收組分樣品池前面的嚴格單色光的強度; I為經程長為 l的樣品池后的出射光強; c為吸光物質的濃度;ε為摩爾消光系統,它與吸收幾率有直接關係。當有多種組分的吸收物質均勻混合時,朗伯-比爾定律可表示為:
1908年J.斯塔克和1912年A.愛因斯坦把能量的量子概念應用到分子的光化學反應上,他們提出了量子活化原則:分子的光吸收是單量子(光子)過程,在初始光化學過程中活化一個分子,所以初始過程的量子產額之和應為 1。這就是光化學第二定律。在常規光化學系統中,屬低光強照射,被吸收光子數為10~10厘米·秒。由於激發態分子的壽命很短,處於電子激發態的分子也只能有很低的濃度,所以第二光子的吸收幾率極小。在高光強照射條件下,例如在閃光光解和某些激光光化學實驗中被吸收光子數為10厘米·秒以上,在高光子密度的光化學反應中有時會發生雙光子吸收。