溶解度曲線
溶解度曲線
溶解度曲線定義是同種物質在不同溫度下的溶解度繪製出來的曲線。由於固體物質的溶解度隨溫度變化而變化,隨溫度一定而一定,這種變化可以用溶解度曲線來表示。
我們用縱坐標表示溶解度,橫坐標表示溫度,繪出固體物質的溶解度隨溫度變化的曲線,這種曲線叫做溶解度曲線。溶解度曲線一般隨著溫度的升高而升高,但是少部分物質會隨著溫度的升高而降低。
用二維坐標繪成的氣液相平衡關係曲線,稱為溶解度曲線,可在有關手冊中查得或通過實驗對具體物系進行測定。圖1、圖2分別表示在同一壓強、不同溫度下,NH和SO在水中的溶解度曲線。
曲線圖
溶解度曲線上的任一點表示平衡狀態時的氣、液組成,說明要使一種氣體在溶液里達到某一濃度,液面上方必須維持該氣體一定的平衡分壓。分析圖1或圖2可知,同一種物系,在相同溫度下,氣體的溶解度隨著該組分在氣相中的分壓增大而增大;在相同的平衡分壓下,氣體的溶解度隨著溫度的升高而減小。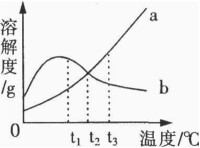

溶解度曲線
由圖3可知,在相同的溫度和同一分壓下,不同的氣體,在同一種溶劑中的平衡組成差別很大。從上面討論我們了解到:①在一定的溫度下,氣體在溶液里達到某一組成,被溶解的氣體都呈現一定的分壓。從這一點看,可視為有三種氣體:易溶的氣體(氨)、中等可溶的氣體(二氧化硫)、微溶的氣體(二氧化硫)。分析下表可以看出,微溶氣體與液體接觸時,需要的液面上方分壓較大,而易溶氣體液面上方需要的分壓較小。②根據溶解度曲線的變化規律,可知,加壓和降溫有利於吸收過程的進行;相反,升溫或減壓則有利於解吸過程的進行。
溶解度曲線
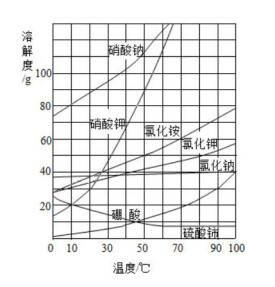
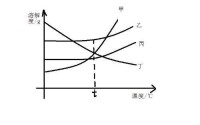
①表示同一種物質在不同溫度時的溶解度或溶解度隨溫度變化的情況;②表示不同物質在同一溫度時的溶解度,可以比較同一溫度時,不同物質的溶解度的大小。若兩種物質的溶解度曲線相交,則在該溫度下兩種物質的溶解度相等;③根據溶解度曲線可以確定從飽和溶液中析出晶體或進行混合物分離提純的方法;④根據溶解度曲線能進行有關的計算。
曲線上點的意義
溶解度曲線
2.溶解度曲線下面的面積上的點,表示溶液所處的狀態是不飽和狀態,依其數據配製的溶液為對應溫度時的不飽和溶液。
3.溶解度曲線上面的面積上的點,依其數據配製的溶液為對應溫度時的飽和溶液,且該溶質有剩餘。
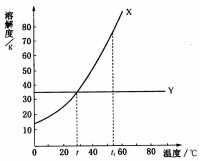
4.兩條溶解度曲線的交點,表示在該點所示的溫度下,兩種物質的溶解度相等。
曲線上線的意義
溶解度曲線表示某物質在不同溫度下的溶解度或溶解度隨溫度的變化情況。曲線的坡度越大,說明溶解度受溫度影響越大;反之,說明受溫度影響較小。溶解度曲線也有三個方面的應用: (1)根據溶解度曲線,可以看出物質的溶解度隨著溫度的變化而變化的情況。 (2)根據溶解度曲線,比較在一定溫度範圍內的物質的溶解度大小。 (3)根據溶解度曲線,選擇分離某些可溶性混合物的方法。
曲線上面的意義
對於曲線下部面積上的任何點,依其數據配製的溶液為對應溫度時的不飽和溶液;曲線上部面積上的點,依其數據配製的溶液為對應溫度時的飽和溶液,且溶質有剩餘。如果要使不飽和溶液(曲線下部的一點)變成對應溫度下的飽和溶液,方法有兩種:第一種方法是向該溶液中添加溶質使之到達曲線上;第二種方法是蒸發一定量的溶劑。
曲線交點的意義
兩條溶解度曲線的交點表示該點所示的溫度下兩物質的溶解度相同,此時兩種物質飽和溶液的溶質質量分數也相同。
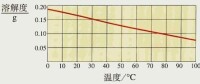
熟石灰的溶解度隨溫度升高而降低
2.少數固體物質的溶解度受溫度的影響很小,曲線為“緩升型”,如氯化鈉。
3.極少數固體物質的溶解度隨溫度的升高而減小,曲線為“下降型”,如氫氧化鈣。
4.氣體物質的溶解度均隨溫度的升高而減小(縱坐標表示體積),曲線也為“下降型“,如氧氣。
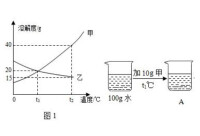
當溶質原子溶入溶劑而形成固溶體時,仍保持原溶劑的固有點陣,但點陣參數則隨溶質量的增多而增大(或減小)。
取A、B含量不同的一系列成分已知的合金,加熱至使B全部溶入A中而形成同溶體,淬火至室溫,精確測定各合僉的點陣參數a。作出溶解量與點陣參數a的關係曲線(如圖a)。當溶解量不大時,所得為一直線。
若事先作出該關係曲線,則可根據所測某固溶體的點陣參數得出其中溶質的含量。
為測得溶解度曲線,取B含量足夠高的合金,在溫度t下長時間保溫,精確測定該固溶體的點陣參數a,在已建立的圖a中作出a的水平線,與直線相交於一點,該點所對應的成分即為固溶體的成分,亦即在溫度t下B在A中的溶解度。同樣可以測出t等其它溫度下的溶解度。將各溫度下的溶解度連接起來,即得出固溶體的溶解度曲線(圖b)。此法稱為外標法。
溶解度曲線
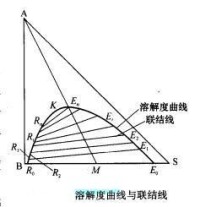
對A與B、S完全互溶、B與S部分互溶的萃取系統,其平衡關係可藉助實驗測定之。具體步驟是:在恆定壓強及溫度的條件下,先將B和S以適當比例混合,其總組成由M點表示。經過充分接觸和靜置后,便得到兩個互為平衡的液相,
其組成如下圖中的E點和R點所示。這兩個互為平衡的液相稱為共軛相,其相應的組成稱為共軛組成。向此混合液中加入少量A並充分混合,使之達到新的平衡,靜置後分層得到一對共軛相,其組成點為E和R。然後繼續加入溶質A,重複上述操作,即可得到若干對共軛相的組成點E和R,直至加入A的量使混合液恰好由兩相變為一相,其組成點由P表示。再加入A,混合液保持單一液相狀態。P點稱為臨界混溶點。將代表各平衡液相組成的點連接起來,便得到實驗溫度下該三元物系的溶解度曲線。
溶解度曲線將三元系分為兩個區域:由溶解度曲線與底邊所圍成的區域為兩相區,溶解度曲線以外的區域為均相區。在兩相區,互成平衡的萃取相E和萃余相R稱為共軛相,是萃取分離可能達到的極限組成。
顯然,萃取分離應控制在兩相區內進行,實際萃取過程因接觸程度不夠,故萃取相和萃余相的組成低於共軛組成,但其相對量符合槓桿規則。
在相同溫度下,萃取劑與組分B的互溶度越小,其兩相區的面積越大,所得萃取相的組成也越大;反之亦然。因此,應儘可能選擇與組分B有較小互溶度的萃取劑以有利於溶質A的分離。
若組分B與組分S完全不互溶,則點R0與E0分別與三角形定點B及定點S相重合。
溶解度曲線與聯結線
1.查找指定溫度時物質的溶解度,並根據溶解度判斷溶解性。
2.比較相同溫度時(或一定溫度範圍內)不同物質溶解度的大小。
3.比較和確定物質的溶解度受溫度影響的程度,並據此確定物質結晶或混合物分離提純的方法。
4.確定溶液的狀態(飽和與不飽和)。