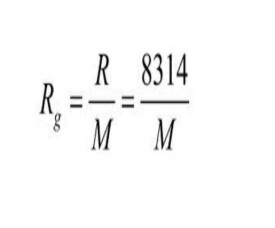共找到2條詞條名為理想氣體常數的結果 展開
- 理想氣體常數
- 氣體常數
理想氣體常數
理想氣體常數
理想氣體常數,又名“通用氣體常數”,是一個在物態方程中連繫各個熱力學函數的物理常數。
n摩爾理想氣體在絕對溫度T,壓強P下,佔有體積V則PV=nRT。此式稱為理想氣體的狀態方程,式中R即通用氣體常數,其數值與氣體種類無關,只與單位有關。Rg=R/M,M是摩爾質量,Rg是氣體常數,如氧氣的氣體常數Rg=8.314/0.032。
對於實際氣體,R與壓力、溫度、氣體種類有關 當溫度較高、壓力較低時,R接近於常數。當T 較高,p→0時,無論何種氣體,均有:
R =(pVm)p→0/T=8.314472J·mol^(-1)·K^(-1)
R=8.314472cm3·MPa·mol^(-1)·K^(-1)
R=8.314472*10^3dm3·Pa·mol^(-1)·K^(-1)
R=8.314472m3·Pa·mol^(-1)·K^(-1)
R=0.0820574587L·atm·mol^(-1)·K^(-1)(atm:一個標準大氣壓)
理想氣體常數(或稱摩爾氣體常數、普適氣體恆量)的數值隨p和V的單位不同而異,以下是幾種常見的表述:
在理想氣體狀態方程中,用於p、V和T刻畫,表達這幾個量之間的關係。
理想氣體常數因為各種真實氣體在壓力趨近於零時都趨近於理想氣體,所以由實驗測出,當溫度為273.15K時,每摩爾任一氣體的值都是22.414L,因此,在法定計量單位中R=8.314J·mol·K。
其它表達式: ,其中 p 是氣體壓力,V是容積, m是氣體質量, Rg某一種氣體的氣體常數, T 氣體溫度, R 氣體常數, M 氣體的分子質量, n 摩爾數。
R同時也出現在能斯特方程及洛倫茲-洛倫茨方程(Lorentz-Lorenz equation)中。
測定原理
任何情況 下絕對遵守玻意耳一馬略特定律 、蓋一呂薩克定律和查理定律的氣體為理想氣體。理想氣體狀態方程為pV=nRT,任何氣體的摩爾數n=m(物質質量)/M(摩爾質量),則常數 ,求出p、V、m、M、T五個未知量,即可求出R。
實驗方法
實驗中先將 HCl用漏斗加入試管底部, 稱取質量為mMg的 Mg 條一根,將Mg 蘸少許水貼在反應試管內壁上 (尚未產生氫氣 ),檢驗裝置是否漏氣 。證實其不漏氣后,把水準瓶與量氣管並列,使兩者水面相平,然後記下量氣管中的水面讀數 V初 , 輕輕搖動試管, 使鎂條落入酸中,反應產生的氫氣使量氣管中的水面下降,反應停止后,待試管冷卻到室溫,再次把水準瓶與量氣管並列,使兩者水面相平,記下量氣管中水面讀數 V終, 待整個體系的溫度與室溫相等后 ,用溫度計測得室溫 T,記錄該溫度下的大氣壓值為 P0 。 則有:
式中△V = V終-V初,從 “分壓定律“”的角度討論得到的計算機 R 的公式與已有化學實驗教材中的公式是一致的。