分子締合
形成雙分子或多分子的締合體
分子締合是指同種或異種分子在分子間力的作用下形成雙分子或多分子的締合體稱為分子締合。所謂締合體常常是非固定的分子結合體,可以不斷地解離和重新締合。在分子締合中起作用的分子間力主要是極性分子之間的庫侖引力,尤其是氫鍵,這是指一個氫原子同時跟兩個負電性很強的原子相結合形成的鍵。
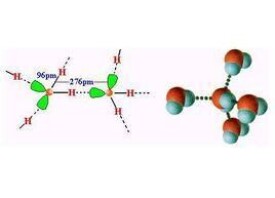
等分子容易發生分子締合,主要原因是形成了氫鍵。形成的分子叫締合分子。分子發生締合時放熱。水分子發生締合,締合()x熱量,相反,()x離解成吸熱。在固態時,大量水分子以氫鍵互相連接成巨型締合分子。其中每個氧原子跟兩個氫原子緊靠,形成O-H鍵(鍵長為101pm,鍵角為109°28',比原來104.5°稍稍擴張),而跟另外兩個氫原子相距很遠,形成鍵長276pm的氫鍵,這就是氫鍵的方向性。這個結構向空間無限周期性地延伸,就形成冰晶體。冰的結構比較疏鬆,出現密度比水小的特殊性質。當冰熔化成液態水時,部分氫鍵遭到破壞,部分締合作用消除,但仍有許多運動自由的、以氫鍵結合的小集團(),不斷地變動、改組,且可堆積得較為緊密。因此冰熔化時體積反而縮小。在氣態時,締合作用完全消失,水就以單個分子存在。分子締合作用除了形成氫鍵的原因外,還可以通過極性分子中偶極的相互作用,以及通過形成配位鍵(如二聚體)而締合。
分子締合
通過特殊的和中等強度的分子間力,使單一種類的分子形成雙分子或多分子的締合體。研究分子締合可以更深刻地理解分子的結構和原子間力的性質。由於這種分子間的鍵合本質上屬於物理作用,因此締合作用一般並不顯著改變原來物質分子的化學性質,但對物質密度、沸點、熔點、蒸發熱等物理性質卻有較顯著的影響。液態、固態或氣態時,在分子締合中起主導作用的分子間力(統稱為范德瓦耳斯作用)主要是極性分子之間基於分子的異極互相吸引而產生的一類相互作用。其中,特別重要而常見的一種強分子間鍵稱為氫鍵。氫鍵是指與元素電負性較大的氟、氧、氮等原子(X)與氫原子成鍵,由於X─H化學鍵有較大的極性,使得該氫原子能進一步與另一個分子中電負性較大的原子X′相鍵連,從而生成按下列模式所示的結合:式中δ-、δ+表示原子的相對電負性及化學鍵的極性點線所示H…X′的原子間距比一般分子間的范氏鍵長(或范氏間距,即相應原子的范德瓦耳斯半徑之和)要短得多,其鍵能則比一般范氏鍵能要大。由於氫原子體積小,在多數場合,H一般只與兩個電負性大的原子相連,且鍵角∠XHX′偏離直線(180度)不超過30度。因此,氫鍵實是一種有方向性的較強的特種范氏鍵。
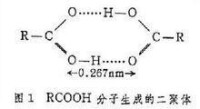
可以用有機物RCOOH類羧酸分子生成二聚體,作為通過氫鍵形成分子締合體的典型實例(如圖1所示)。在極性溶劑中,可以通過對化學式量的測量證實這種二聚體的存在。
分子締合
分子締合
分子締合多方面的實驗證據和跡象表明:當冰融化為水后,液態水中的氫鍵並未全被破壞,而是存在著通過氫鍵締合起來的分子締合體,其中n是締合體中水分子的數目。這種締合物在液態中不斷重排,處於解離與再締合的動態平衡之下。根據紅外吸收譜帶的實驗數據估算,締合體中平均水分子數n在20°C時為90;在0°C時為130;在72°C時為60(溫度升高將使締合度下降)。水分子的這種締合作用,對闡明水的性質有重要的理論和實際意義。如在周期表中氧周圍諸元素的氫化物等在常溫下都是氣體,而水則為液體,這顯然與水分子間存在著強分子間鍵有關。因為水分子能形成這種動態平衡的締合體,可滿意地闡明H+、OH-等離子在水中具有很高的遷移率,而水具有很高的介電常數,則是水作為一個優良極性溶劑的基礎。締合作用也可發生在不同種類的分子之間,如在氨分子與水分子之間可形成異分子的締合體。
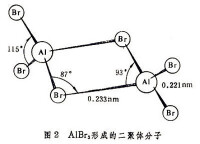
在有些特殊場合下,締合作用也可在一定程度上向化學鍵過渡。如在精密測定農藥氟硅酸脲的晶體時,證明4:1的尿素與氟硅酸的加合物內,氟硅酸的二個質子已被兩對尿素分子通過強對稱氫鍵所俘獲,此加合物結構式可表達為式中左側的分子締合體可稱為脲合質子或脲化質子,其中質子H+與二個氧原子O是等距離的,而O…H+…O氫鍵的距離要比常規非對稱O─H…O氫鍵短得多。在這種類型的對稱強氫鍵中已包含有一定化學鍵的成分,在這個意義上可將這種締合體稱為締合分子。鋁的三氯和三溴化合物可形成二聚體分子、。此類二聚體分子中,連接Al、Cl或Al、Br原子間的鍵均為化學鍵,與前述一般分子締合作用有質的不同。圖2中示出所形成的二聚體分子。