格林尼亞試劑
格林尼亞試劑
格林尼亞試劑簡稱“格氏試劑”。是含鹵化鎂的有機金屬化合物,由於含有碳負離子,因此屬於親核試劑,由法國化學家維克多·格林尼亞(François Auguste Victor Grignard)發現。格氏試劑在有機合成上十分有用。
由法國化學家格林尼亞於1901年所創始。由有機鹵素化合物(鹵代烷、活潑鹵代芳烴)與金屬鎂在絕對無水乙醚中反應形成有機鎂試劑,稱為“格林尼亞試劑”,簡稱“格氏試劑”。后法國化學家諾爾芒於1953年以四氫化呋喃(THF)作為溶劑得到了格氏試劑。該項改進稱為“格林尼亞-諾爾芒反應”。
現常用鹵代烴與鎂粉在無水乙醚或四氫呋喃(THF)中反應製得,製備過程必須在絕對無水無二氧化碳無乙醇等具有活潑氫的物質條件下進行。通常以通式R-Mg-X表示。格氏試劑是一種活潑的有機合成試劑,能夠發生:偶連、加成、取代等多種類型反應,在有機合成中具有較高應用價值。
格氏試劑一般有兩種,1:氯苯類(氯化苄)在乙醚(四氫呋喃)下和鎂反應,2:溴代環戊烷在乙醚(四氫呋喃)下和鎂(鋅)反應。
簡稱格氏試劑。一類通式為R-Mg-X的試劑,式中R為脂肪烴基或芳香烴基,X為鹵素(Cl、Br或I)。通常用鹵代烴和金屬鎂在無水乙醚或四氫呋喃中製取。性質極為活潑,可與具有活潑氫的化合物(如H2O,ROH,RC≡CH…)醛、酮、酯、醯鹵、腈、環氧乙烷、鹵代烷、二氧化碳、三氯化磷、三氯化硼、四氯化硅等反應。為重要的有機合成試劑。
格氏試劑是共價化合物,鎂原子直接與碳相連形成極性共價鍵,碳為負電性端,因此格氏試劑是極強的路易斯鹼,能從水及其它路易斯酸中奪取質子,故格氏試劑不能與水,二氧化碳接觸,需格氏試劑的製備和引發的反應需要在無水,隔絕空氣條件下進行。
格氏試劑一般由鹵代烴與鎂粉在無水乙醚或四氫呋喃(THF)中反應製得。(鹵代苯必須在THF中反應)格氏試劑可與醚或四氫呋喃中的氧原子形成絡合物,製備過程必須在絕對無水無二氧化碳無乙醇等具有活潑氫的物質(如:水、醇、氨、鹵化氫、末端炔等)條件下進行。
在有活潑氫物質或者THF中:R-Br+Mg→R-Mg-X
由於碘代烷價格較高,一般用溴代烷合成。溴代烷是最常用於製備格氏試劑的鹵代烴,但由於氯、溴甲烷均為氣體,使用不便,一般使用碘甲烷合成碘化甲基鎂。氯苯在製備格氏試劑時還須控制溫度與壓力。烯丙型及苯甲基型格氏試劑,合成後會與尚未反應的鹵代烴發生偶合,因而需要嚴格控制溫度。
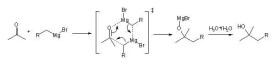
在250mL三口燒瓶上,配置攪拌器、恆壓滴液漏斗和帶有CaCl2乾燥管的迴流冷凝管。向三口燒瓶中置入2.9g(0.12mol)鎂屑,用20mL無水乙醚浸沒。攪拌下,先滴入5mL 25%鹵代烴乙醚溶液(由0.12mol鹵代烴和無水乙醚配製而成)。如果反應液呈現混濁狀並且溫度上升,表明反應已經開始。如果沒有產生上述現象,則需要加入1~2小粒碘晶,並微微加熱。片刻,碘的顏色開始漸漸消褪,溶液變混濁,反應即開始,停止加熱。將餘下的鹵代烴溶液滴入反應瓶中,滴速以維持反應液平穩沸騰為宜。加畢,用溫水浴加熱迴流約半小時,使反應完全,即得格氏試劑乙醚溶液。
(1)不論何時都不要將乙醚蒸干。
(2)所用儀器均需乾燥。溶劑和試劑都必須經過乾燥處理。
(3)可用熱水浴加熱,切不可用明火加熱。
(4)空氣中的氧會與格氏試劑發生緩慢的氧化,格氏試劑的乙醚溶液在暗室里會發出美麗的光,就是這個緣故。因此,格氏試劑不可久置,通常隨制隨用。
格林試劑和某些活潑氫化合物(水、醇、酸等)、CO2、羰基化合物、金屬或非金屬鹵代物等的反應成為格林尼亞反應。常用以製備烴類、醇、酮、酸等。例如: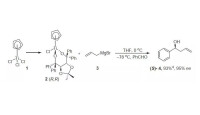

格林尼亞試劑