親核試劑
親核試劑
親核試劑(nucleophile,意思為原子核的喜好物),又叫親核基,指具有親核性的化學試劑,可用:Nu表示。一些帶有未共享電子對的分子或負離子,與正電性碳反應時稱為親核試劑。所謂親核試劑就是一種電子對供體,即路易斯鹼。在反應過程中,它傾向於與電正性物種結合,因為原子核是電正性的,所以“親核”即是指親“電正性”。
在極性反應中,親核試劑提供能量較高的電子對,用於形成新鍵。親核試劑的電子對可以是親核原子上的未共用電子對或負電荷,也可來自於試劑分子中σ鍵或π鍵的異裂。根據親核試劑如何提供電子對,將親核試劑分成三種類型:未共用電子對型親核試劑(lone—pair nucleophiles),σ鍵型親核試劑(σ一bond nucleophiles)和π鍵型親核試劑(π一bond nucleophiles)。
親核試劑的親核原子上有未共用的電子對,可用於與親電試劑的親電原子形成新鍵。
例如,以下親核反應中,胺作為未共用電子對型親核試劑提供電子,與親電試劑成鍵:
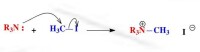
未共用電子對型
未共用電子對型親核試劑
當非金屬原子與金屬原子之間形成共價鍵時,由於非金屬原子的電負性通常較大,使得非金屬原子帶部分負電荷,金屬原子帶部分正電荷。在極性反應中,這類化合物分子中非金屬原子與金屬原子之間的共價鍵可以異裂,非金屬原子作為親核原子帶著成鍵電子對參與反應,因此稱這類親核試劑為σ鍵型親核試劑。
例如,氫化鋁鋰與羰基化合物反應時,氫化鋁鋰分子中的Al—H鍵發生異裂,氫帶著成鍵電子與羰基碳發生親核加成。
σ鍵型親核試劑的親核原子可以是雜原子(如NaNH或KOH),也可以是碳原子(如RMgBr、RLi和RCuLi)或氫原子(如NaBH和LiAIH)。但是,強極性的非金屬一金屬鍵Nu—M常被認為是離子鍵(Nu M )。例如下圖所示的幾種試劑通常寫成離子鍵的形式:
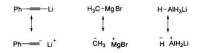
有機金屬試劑的離子鍵結構示意圖
利用π鍵的成鍵電子對與親電試劑的親電原子形成σ鍵。例如,烯烴的π鍵在反應中可以發生異裂,其中的一個雙鍵碳原子帶著成鍵電子對與親電試劑反應。因此,富電子烯烴是親核試劑。
π鍵發生異裂
由於親核試劑在反應中提供電子,按照Lewis酸鹼理論,提供電子的為鹼,因此,親核試劑通常呈鹼性。許多親核反應在鹼性條件下進行,了解親核性與鹼性的關係很重要。親核試劑的親核性強弱通常用其與親電試劑反生的速率來衡量。
例如,根據其在25℃的水溶液中與CHBr發生親核取代反應的速率來衡量。因此,親核性是動力學性質。試劑的鹼性是其與H 反應的能力(用平衡常數的負對數表示),是熱力學性質。試劑的親核性與鹼性有聯繫,也有區別。
試劑的親核性和鹼性的強弱與親核原子周圍的空間位阻、電荷離域、反應介質等因素均有關係。
1、親核原子周圍立體位阻增加,親核性顯著降低,鹼性則變化不大。
例如,EtO 是強鹼(pK=17)和強親核試劑,而t-BuO 的親核性則非常小,但鹼性卻略有增加(pK=19)。這類強鹼弱親核試劑有時也稱為非親核鹼,在親核反應中作為鹼催化劑被廣泛應用。
2、電荷離域使鹼性顯著降低,對親核性影響則較小。例如,EtO (pK=17)在較低溫度下與s-BuBr反應,起鹼的作用,生成消除產物2—丁烯;而AcO-(pK=4.7)在較高的溫度下能作為親核試劑與s-BuBr發生S2反應生成s-BuOAc。
3、反應介質對試劑的親核性也有重要影響,特別是極性非質子溶劑可以顯著增加試劑的親核性,常作為親核反應的溶劑。常用的極性非質子溶劑如圖:
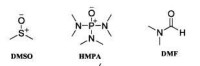
極性非質子溶劑
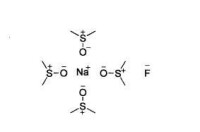
二甲亞碸中氟化鈉的溶劑化