補體活化途徑
補體活化途徑
補體活化途徑(activating pathway of complements),也稱作補體系統。補體的各成分為抗原抗體複合體以及其他成分,離子等相繼會合連鎖被活化,結果引起免疫細胞溶解(immune cytolysis)和免疫溶血(immune haemolysis),也就是細胞和細菌、紅血球等的溶解或免疫粘著等許多免疫生物學現象。
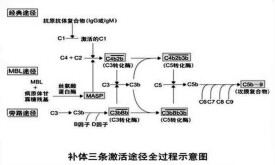
補體活化途徑大致可分為兩種途徑,第一補體途徑(classical pathway)和第二途徑,第二途徑亦稱為代替途徑(alternate pathway)。據說第二途徑與彼列莫(L.Pillemer)等所提倡的備解素系統據說是同一途徑,與第一補體途徑相比,可由更單純的物質引起,在比較低等的動物中也能看到。
補體在溶菌或溶血反應時被激活的過程中,11種成分可分為3個功能單位,即①識別單位:包括C1q、C1r、C1s;②活化單位:包括C2、C3、C4,③膜攻擊單位:包括C5、C6、C7、C8和C9。同一功能單位的補體成分彼此間有化學親和性,激活后可相互結合在一起,共同執行使細胞溶解這一生物學功能。因此,補體的經典激活途徑可分為識別、活化和膜攻擊3個階段。這3個階段一般在靶細胞膜的3個不同部位進行。補體在激活過程中C2、C3、C4、C5均分別裂解成2個或2個以上的片段,分別標以a、b等符號,如 C3a、C3b、C3c等。其中C2b、C3b、C4b、C5b直接或間接結合在靶細胞上,以固相的形式參與溶細胞過程,C3a、C5a遊離在液相。補體在激活過程中, C5、C6、C7經活化后還可聚合成 C567.並與C3a、C5a一起發揮特殊的生物學功能.
參與補體經典激活途徑的成分包括C1-C9。按其在激活過程中的作用,人為地分成三組,即識別單位(Clq、Clr、Cls)、活化單位(C4、C2、C3)和膜攻擊單位(C5-C9),分別在激活的不同階段即識別階段、活化階段和膜功擊階段中發揮作用。
(一)識別階段
Clq:Clq分子有6個能與免疫球蛋白分子上的補體結合點相結合的部位。當兩個以上的結合部位與免疫球蛋白分子結合時,即Clq橋聯免疫球蛋白之後,才能激活後續的補體各成分,IgG為單體,只有當其與抗原結合時,才能使兩個以上的IgG分子相互靠攏,提供兩個以上相鄰的補體結合點才能與Clq接觸,只有當IgM與抗原結合,發生構型改變,暴露出補體結合部位之後,才能與Clq結合。一個分子的IgM激活補體的能力大於IgG。Clq與補體結合點橋聯后,其構型發生改變,導致Clr和Cls的相繼活化。
Clr:Clr在C1大分子中起著連接Clq和Cls的作用。Clq啟動后可引起Clr構型的改變,在活性的Clr,後者可使Cls活化。
Cls:Clr使Cls的肽鏈裂解,其中一個片段Cls具有酯酶活性,即CI的活性。此酶活性可被C1INH滅活。
在經典途徑中,一旦形成Cls,即完成識別階段,並進入活化階段。
(二)活化階段
CI作用於後續的補體成分,至形成C3轉化酶(C42)和C5轉化酶(C423)的階段。
C4:C4是CI的底物。在Mg2 存在下,CI使C4裂解為C4a和C4b兩個片段,並使被結合的C4b迅速失去結合能力。CI與C4反應之後能更好地顯露出CI作用於C2的酶活性部位。
C2:C2雖然也是CI的底物,但CI先在C4作用之後明顯增強了與C2的相互作用。C2在Mg2 存在下被CI裂解為兩個片段C2a和C2b。當C4b與C2a結合成C4b2b(簡寫成C42)即為經典途徑的C3轉化酶。
C3:C3被C3轉化酶裂解在C3a和C3b兩個片段,分子內部的疏酯基(-S-CO-)外露,成為不穩定的結合部位。硫酯基經加水分解,成為-SH和-COOH也可與細菌或細胞表面的-NH2和-OH反應而共價結合。因此,C3b通過不穩定的結合部位,結合到抗原抗體複合物上或結合到C42激活C3所在部位附近的微生物、高分子物質及細胞膜上。這點,對於介導調理作用和免疫粘附作用具有重要意義。C3b的另一端是個穩定的結合部位。C3b通過此部位與具有C3b受體的細胞相結合。C3b可被I因子滅活。C3a留在液相中,具有過敏毒素活性,可被羥肽酶B滅活。
(三)膜攻擊階段
C5轉化酶裂解C5后,繼而作用於後續的其他補體成分,最終導致細胞受損、細胞裂解的階段。
C5:C5轉化酶裂解C5產生出C5a和C5b兩個片段。C5a遊離於液相中,具有過敏毒素活性和趨化活性。C5b可吸附於鄰近的細胞表面,但其活性極不穩定,易於衰變成C5bi。
C6-C9:C5b雖不穩定,當其與C6結合成C56複合物則較為穩定,但此C5b6並無活性。C5b6與C7結合成三分子的複合物C5b67時,較穩定,不易從細胞膜上解離。
C5b67即可吸附於已致敏的細胞膜上,也可吸附在鄰近的,未經致敏的細胞膜上(即未結合有抗體的細胞膜上)。C5b67是使細胞膜受損傷的一個關鍵組分。它與細胞膜結合后,即插入膜的磷脂雙層結構中。
若C5b67未與適當的細胞膜結合,則其中的C5b仍可衰變,失去與細胞膜結合和裂解細胞的活性。
C5b67雖無酶活性,但其分子排列方式有利於吸附C8形成C5678。其中C8是C9的結合部位,因此繼續形成C5-9,即補體的膜攻擊單位,可使細胞膜穿孔受損。
-不C5b、C6、C7結合到細胞膜下是細胞膜仍完整無損;只有在吸附C8之後才出現輕微的損傷,細胞內容物開始滲漏。在結合C9以後才加速細胞膜的損傷過程,因而認為C9是C8的促進因子。
旁路激活途徑與經典激活途徑不同之處在於激活是越過了C1、C4、C2三種成分,直接激活C3繼而完成C5至C9各成分的連鎖反應,還在於激活物質並非抗原抗體複合物而是細菌的細胞壁成分—脂多糖,以及多糖、肽聚糖、磷壁酸和凝聚的IgA和IgG4等物質。旁路激活途徑在細菌性感染早期,尚未產生特異性抗體時,即可發揮重要的抗感染作用。
(一)生理情況下的準備階段
在正常生理情況下,C3與B因子、D因子等相互作用,可產生極少量的C3B和C3bBb(旁路途徑的C3轉化酶),但迅速受H因子和I因子的作用,不再能激活C3和後續的補體成分。只有當H因子和I因子的作用被阻擋之際,旁路途徑方得以激活。
C3:血漿中的C3可自然地、緩慢地裂解,持續產生少量的C3b,釋入液相中的C3b迅速被I因子滅活。
B因子(fB):液相中緩慢產生的C3b在Mg2 存在下,可與B因子結合形成C3bB。
D因子(fD):體液中同時存在著無活性的D因子和有活性的D因子(B因子轉化酶)。D因子作用於C3bB,可使此複合物中的B因子裂解,形成C3bBb(C3轉化酶)和Ba遊離於液相中。C3bBb可使C3裂解為C3a和C3b,但實際上此酶效率不高亦不穩定,H因子可置換C3bBb複合物中的Bb,使C3b與Bb解離,解離或遊離的C3b立即被I因子滅活。因此,在無激活物質存在的生理情況下,C3bBb保持在極低的水平,不能大量裂解C3,也不能激活後續補體成分。但是這種C3的低速度裂解和低濃度C3bBb的形成,具有重大意義。可比喻為處於“箭在弦上,一觸即發”的狀態。
P因子(fP):備解素,與C3bBb結合形成C3bBbP(C3轉化酶)。
(二)旁路途徑的激活
旁路途徑的激活在於激活物質(例如細菌脂多糖、肽聚糖;病素感染細胞、腫瘤細胞,痢疾阿米巴原蟲等)的出現。激活物質的存在為C3b或C3bBb提供不易受H因子置換Bb,不受Ⅰ因子滅活C3b的一種保護性微環境,使旁路激活途徑從和緩進行的準備階段過渡到正式激活的階段。
(三)激活效應的擴大
C3在兩條激活途徑中都佔據著重要的地位。C4是血清中含量最多的補體成分,這也正是適應其作用之所需。不論在經典途徑還是在旁路途徑,當C3被激活物質激活時,其裂解產物C3b又可在B因子和D因子的參與作用下合成新的C3bBb。後者又進一步使C3裂解。由於血漿中有豐富的C3,又有足夠的B因子和Mg2 ,因此這一過程一旦被觸發。就可能激活的產生顯著的擴大效應。有人稱此為依賴C3Bb的正反饋途徑,或稱C3b的正反饋途徑。
補體激活的途徑之一,由血漿中甘露聚糖結合凝集素(mannan-binding lectin,MBL)或纖維膠凝蛋白(ficolin,FCN)直接識別多種病原微生物表面的甘露糖、N-乙醯甘露糖、N-乙醯葡萄糖氨、岩藻糖等為末端糖基的糖結構。MBL-MASP複合物與病原體表面糖結構結合,使MASP-1、MASP-2被獨立地激活。活化的MASP2發揮其SP活性,裂解C4,所產生的C4b片段共價結合於病原體表面,通過與C2相互作用,使後者也被MASP2裂解,形成C3轉化酶C4b2a,繼之活化補體CP;活化的MASP1能直接裂解C3產生C3b,在fD和fP的作用下,形成C3轉化酶C3bBb或C3bBbP,併產生C5轉化酶C3bBb3b,激活補體AP。
過程:fP特異性識別→非共價結合於靶細胞表面→招募體液中的C3b和fB→形成C3bBP→在fD作用下生成C3bBbP。
某些蛋白酶或因子可以直接激活補體。
MΦ(誘導性)和PMN(組成性)表達膜型絲氨酸蛋白酶,可裂解C3、C5產生C3a、C5a,在補體介導的T細胞免疫調節中起重要作用。