免疫球蛋白a
以單體和雙體的形態存在
免疫球蛋白A(Immunoglobulin A,縮寫:IgA),是血清中的含量僅次於IgG,占血清免疫球蛋白的10~20%,存在於黏膜組織,例如消化道、呼吸道以及泌尿生殖系統。黏膜組織具有黏膜層淋巴組織,會製造出IgA以避免遭到病原的入侵,也存在於唾液、淚液以及乳汁當中,尤其是初乳,其IgA的含量相當高。
在人體中,IgA的結構主要以單體和雙體的形態存在。依照IgA在身體體內的分佈,又可以分成血清型和分泌型。血清型IgA為單體,免疫作用比較弱。分泌型IgA有雙體和三體,是機體黏膜防禦系統的主要成分,廣泛分佈於乳汁、唾液以及胃腸道、呼吸道、泌尿生殖道黏膜分泌液中。它能抑制微生物在呼吸道上皮附著,減緩病毒繁殖,有重要的免疫屏障作用,對某些病毒、細菌和—般抗原具有抗體活性,是防止病原體入侵機體的第一道防線。IgA不能通過胎盤。新生兒血清中無IgA抗體,但可從母乳中獲得分泌型IgA。新生兒出生4~6個月後,血中可出現IgA,以後逐漸升高,到青少年期達到高峰。
免疫球蛋白A(簡稱為IgA)。IgA分兩種類型:即血清型IgA和分泌型IgA。血清型IgA存在於血清中,血清IgA具有某些IgG和IgM的免疫功能,特異性IgA能中和血液中的抗原,同時也出現替代性補體免疫系統。分泌型IgA存在於分泌液中,例如:唾液、淚液以及乳汁當中,均含有IgA抗體。分泌型IgA是機體局部黏膜抗感染免疫的主要抗體。故又稱黏膜免疫抗體。IgA不能通過胎盤。新生畜血清中無IgA抗體,但可從母乳中獲得分泌型IgA。

免疫球蛋白a
IgA存在於兩種同種型IgA1和IgA2中。它們都是高度糖基化的蛋白質。雖然IgA1在血清中佔優勢(~80%),但IgA2在分泌物中的含量高於血清(在分泌物中約為35%); IgA1和IgA2分泌細胞的比例在人體不同的淋巴組織中有所不同:
IgA1是血清中發現的主要IgA亞類。大多數淋巴組織具有產生IgA1的細胞的優勢。
在IgA2中,重鏈和輕鏈不與二硫鍵連接,而是與非共價鍵連接。在分泌型淋巴組織(例如,腸相關淋巴組織或GALT)中,IgA2產生的份額大於非分泌性淋巴器官(例如脾,外周淋巴結)中的份額。
IgA1和IgA2都存在於外部分泌物中,如初乳,母乳,眼淚和唾液,其中IgA2比血液中更為突出。多糖抗原傾向於比蛋白質抗原誘導更多的IgA2。
IgA1和IgA2都可以是膜結合形式。

免疫球蛋白a
也可以根據其位置 - 血清IgA與分泌型IgA來區分IgA的形式。
在分泌型IgA中,在分泌物中發現的形式,2-4個IgA單體的聚合物通過另外兩個鏈連接;因此,slgA的分子量為385,000D。其中之一是J鏈(連接鏈),其是分子量為15kD的多肽,富含半胱氨酸並且在結構上與其他免疫球蛋白鏈完全不同。該鏈在IgA分泌細胞中形成。
外(粘膜)分泌物中的寡聚形式的IgA還含有分子量大得多(70kD)的多肽,稱為由上皮細胞產生的分泌成分。該分子來源於聚-Ig受體(130kD),其負責寡聚(但非單體)IgA在上皮細胞上的攝取和跨細胞轉運以及分泌物如淚液,唾液,汗液和腸液。
分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)是20世紀60年代初在外分泌液中發現的一種IgA抗體,主要存在於乳汁、胃腸液、呼吸道分泌液等外分泌液中。SIgA分子是由2個IgA單體(每個單體含2條輕鏈和2條重鏈)、1條J鏈和1條分泌片(secretory component,SC,為多聚免疫球蛋白受體的胞外裂解片段)構成的異源十聚體,為了與血清IgA單體相區別而被命名為SIgA。研究表明,SIgA是外分泌液中存在的一種主要抗體,是呼吸道、消化道、泌尿生殖道等抵禦病原體及有害物質的第一道免疫防線,是機體黏膜免疫最重要的抗體。
二聚體IgA(dIgA)或多聚體IgA(pIgA)從漿細胞分泌出來后,在上皮細胞的嗜鹼性側與多聚免疫球蛋白受體(polyim-munoglobulinreceptor,pIgR)以共價健形成dIgA-pIgR或pIgA-pIgR複合物,然後通過內吞作用和轉運被運輸到黏膜外側,此後完整的SIgA分子通過pIgR分裂(pIgRC端跨膜部分和胞內部分在黏膜上皮細胞內降解)釋放出來。SIgA在保護機體免受黏膜表面的微生物侵襲方面起著非常重要的作用,其合成與抗原提呈、淋巴細胞歸巢遷移(trafficking)及周圍環境中的細胞因子均有很大關係。在黏膜免疫誘導部位,抗原加工、提呈后,形成針對抗原的IgA型B細胞。在此過程中,B細胞的分化、增殖有賴T細胞的幫助。其中多種Th2樣因子參與了誘導部位B細胞增殖、分化,相關因子包括TGF-β、IL-4等。前體B細胞在誘導部位內進行同種型轉換(isotypeswitch),形成膜表面抗體IgA陽性的B細胞,同種型轉換是形成IgA型漿細胞的關鍵之一。體外研究發現,在TGF-β作用下,B細胞基因重排,使Cα基因得以表達,從而使其轉型為IgA型B細胞。但有研究證實IL-4的作用遠高於TGF-β。在體內實驗中,證實IL-4是調控B細胞在PP(潘氏結)內分化的主要因子,IL-4-/-小鼠失去合成IgA的功能,提示IL-4對於IgA的合成十分重要。
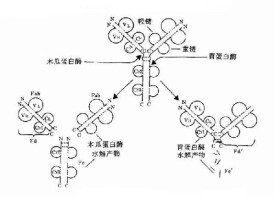
IgA在分泌物中主要以二聚體形式存在,SIgA是由十肽組成的免疫球蛋白,來自2個不同的細胞系,沉降係數為11S,它包含2個單體的IgA、1條J鏈和1個分泌片,它們通過共價結合就形成所謂的SIgA。
單體IgA主要存在於血清中,含量較低,其沉降係數為7S,相對分子質量約為165×103,是重鏈為α的免疫球蛋白。IgA分子由2條κ鏈或2條λ鏈和2條α鏈構成,α鏈稍大於γ鏈。IgA經木瓜蛋白酶水解可以得到3個大小相當的片段,其中有2個相同的片段因具有抗原特異性結合能力,而被稱為抗原結合片段(fragment antigen binding,Fab)。另一個片段是含有Cα2和Cα3的重鏈片段,它能從溶液中結晶出來,呈明顯的均一性,故被稱為結晶片段(fragment crystallizablc,Fc),Fc不能結合抗原,但具有各類Ig的抗原決定簇及生物活性,Ig的許多效應功能由Fc部分介導。Fab和Fc之間有一個鉸鏈區(hingeregion),它的存在可以保證抗體分子的柔性,從而使抗體分子的許多結合位點在空間上能與抗原相互作用。人類的IgA包括IgA1和IgA2共2個亞型,它們由不同的基因表達。IgA1和IgA2的最大不同之處在於IgA1的鉸鏈區比IgA2多13個氨基酸殘基。IgA2有3種亞型,即IgA2m(1)、IgA2m(2)和IgA2n。
人類J鏈是相對分子質量約15×103的多肽,與其他物種的J鏈高度同源。人J鏈基因有4個外顯子,外顯子1編碼前導肽,外顯子2~4編碼含有137個氨基酸殘基的成熟肽,J鏈基因不是Ig基因簇的一部分,它定位於15號染色體。人類J鏈有8個半胱氨酸殘基,Cys15和Cys69通過二硫鍵與IgA的α鏈相連,其他6個半胱氨酸殘基形成鏈內二硫鍵(Cys13∶Cys101,Cys72∶Cys92,Cys109∶Cys134)。Johansen等發現,J鏈C端對於IgA聚合體的形成並非必要,但對於保持與SC的親和力有著重要的作用;同時他們也發現,2個鏈內二硫鍵(Cys13∶Cys101和Cys109∶Cys134)對於SC的結合是不可缺少的,但對於IgA聚合體形成則可有可無,僅Cys15或Cys69的存在就足夠保持多聚體IgA的穩定性。J鏈產生於合成IgA和IgM的漿細胞中,而且也產生於合成IgG的未成熟漿細胞,但它並不與IgG分子結合。用J鏈-/-鼠實驗發現pIgA不能與SC結合,也不能被表達SC的上皮細胞有效轉運,這說明J鏈參與了SC介導的轉運。J鏈不僅是SC結合IgA的重要媒介,而且還在通過調節IgA結構而影響IgA在細胞內裝配中起重要作用。
SC是上皮細胞上的pIgR的一部分,pIgR為免疫球蛋白超家族成員。pIgR由上皮細胞產生,與pIgA特別是dIgA相結合,成為IgA聚合體的轉運受體,是SIgA的重要組成部分。人Fc介導子pIgA和pIgR的相互作用,pIgR細胞外部分包含5個與免疫球蛋白相似的功能域(D1~D5)。其中D1在與dIgA的Cα3功能域非共價結合過程中起了重要的作用,D5與IgA的Cα2共價結合使複合物分子更加穩定。正是SC的存在,使SIgA對蛋白酶的敏感性下降,黏液更黏稠,增強了黏附作用及防禦能力。在SIgA的運輸過程中,pIgR的細胞外部分與分泌性抗體結合成為固定SC,即我們經常所指的SC,可抵抗蛋白酶的降解,從而起到穩定SIgA的作用。有些未與SIgA結合的pIgR分子也被轉運到黏膜外側,並通過水解與細胞脫離,形成遊離SC,與固定SC相似,亦為相對分子質量為80×103的蛋白。SC是黏膜免疫系統的重要組分,參與SIgA形成和分泌,在SC-/-轉基因小鼠中,由於SC基因的缺失,不能進行pIgA的選擇性上皮運輸,導致該小鼠完全沒有黏膜免疫功能。
與普通的抗體分子相比,SIgA具有許多優良特性。SIgA分子中的J鏈將2個IgA單體連接起來,由於每個IgA單體具有2個抗原結合部位,因此每個SIgA抗體即有4個抗原結合位點(四價),從而比普通抗體分子具有更高的親和力。SIgA具有很高的穩定性,其在黏膜表面的半衰期為IgG的3倍,其在人體外分泌道中的保護作用可以持續4個月以上。這種高穩定性主要是由以下幾種因素所致:一是由於SIgA的鉸鏈區較之其他抗體分子短,而鉸鏈區是最容易受到蛋白酶攻擊的部位,鉸鏈區的縮短有利於抵抗蛋白酶的降解;二是由於SIgA的分泌片高度穩定,其多糖側鏈具有防止蛋白酶降解的作用,分泌片對抗體分子的包裹使整個抗體分子變得十分穩定。此外,分泌片還賦予SIgA特殊的免疫保護作用:首先,分泌片具有非特異性的病原微生物中和活性;其次,分泌片上的糖基黏附於黏膜上皮,更使SIgA整齊地排列在黏膜表面,形成隔離保護層,可有效地阻止病毒的入侵。
在血液中,IgA與稱為FcαRI(或CD89)的Fc受體相互作用,Fc受體在免疫效應細胞上表達,從而引發炎症反應。通過含有IgA的免疫複合物連接FcαRI引起抗體依賴性細胞介導的細胞毒性(ADCC),嗜酸性粒細胞和嗜鹼性粒細胞的脫粒,單核細胞,巨噬細胞和中性粒細胞的吞噬作用,以及多形核白細胞引發的呼吸爆發活動。
粘膜區域中IgA的高患病率是產生聚合IgA(pIgA)的漿細胞和表達稱為聚合Ig受體(pIgR)的免疫球蛋白受體的粘膜上皮細胞之間的合作的結果。 pIgA從附近的活化漿細胞釋放並與pIgR結合。這導致IgA在粘膜上皮細胞中的轉運及其從pIgR的切割以釋放到外部分泌物中。
針對特定抗原的sIgA的產生取決於M細胞和潛在的樹突細胞的取樣,T細胞活化以及GALT,腸系膜淋巴結和小腸中的分離的淋巴濾泡中的B細胞類別轉換。
聚合IgA(主要是分泌二聚體)由粘膜表面附近的固有層中的漿細胞產生。它與上皮細胞基底外側表面的多聚免疫球蛋白受體結合,並通過內吞作用進入細胞。受體-IgA複合物在分泌到上皮細胞的腔表面上之前穿過細胞區室,仍然附著在受體上。發生受體的蛋白水解,並且二聚體IgA分子與被稱為分泌成分的受體的一部分一起在整個腔內自由擴散。在腸道中,IgA可以與覆蓋上皮細胞的粘液層結合。以這種方式,形成了能夠在威脅到達上皮細胞之前中和威脅的屏障。
sIgA主要通過阻斷上皮受體(例如通過將它們的配體結合在病原體上),通過空間阻礙與上皮細胞的附著以及通過免疫排斥來起作用。由於sIgA是一種不良的調理素和補體的激活劑,簡單地結合病原體不一定足以包含它 - 特異性表位可能必須被結合以在空間上阻礙進入上皮細胞。
免疫排斥是通過將多價抗原或抗原與抗體交聯,將它們捕獲在粘液層中和/或清除它們的蠕動來凝集多價抗原或病原體的過程。 IgA成分的寡糖鏈可以與位於上皮細胞頂端的粘液層相關聯。
IgA的清除至少部分地由去唾液酸糖蛋白受體介導,其識別終止半乳糖的IgA N-聚糖。
血清IgA具有多種抗體活性,如同種血凝素,抗胰島素,抗布氏菌,抗白喉毒素,抗脊髓灰質炎病毒抗體等。有人認為IgA與組織抗原或蛋白抗原具有特殊結合力,從而可消除進入循環中的此類抗原,防止這些抗原誘導的炎症或自身免疫。已發現,若IgA缺乏,可伴有體內抗甲狀腺球蛋白、腎上腺組織、DNA等的自身抗體水平升高。
SIgA對機體局部免疫,如保護呼吸道、消化道粘膜有重要作用。SIgA合成功能低下的幼兒易患呼吸道或消化道感染;老年性支氣管炎也可能與呼吸道SIgA合成功能降低有關。由於外分泌液中SIgA含量多,又不易被一般蛋白酶破壞,故成為抗感染、抗過敏的一道重要的免疫“屏障”。
由於遺傳不能產生IgA而導致的IgA減少或缺失被稱為選擇性IgA缺乏,並且可以產生臨床上顯著的免疫缺陷。
抗IgA抗體,有時存在於IgA低或缺乏的個體中,當輸入偶然含有IgA的血液製品時,可導致嚴重的過敏反應。然而,大多數疑似IgA過敏反應的人都經歷過急性全身反應,這些反應來自抗IgA輸注以外的原因。
IgA腎病是由腎臟中的IgA沉積物引起的。目前尚不清楚為什麼IgA沉積物會發生在這種慢性疾病中。一些理論認為免疫系統的異常會導致這些沉積物。
由於存在IgA抗內毒素抗體,乳糜瀉涉及IgA病理學。
Henoch-Schönlein紫癜(HSP)是由小血管中IgA和補體成分3(C3)沉積引起的全身性疾病。 HSP通常發生在小孩身上,涉及皮膚和結締組織,陰囊,關節,胃腸道和腎臟。它通常伴隨上呼吸道感染,並在肝臟清除IgA聚集體後幾周內消退。
線性IgA大皰性皮膚病和IgA天皰瘡是IgA介導的免疫性疾病的兩個實例。即使使用通常有效的藥物如利妥昔單抗,IgA介導的免疫性疾病通常也難以治療。
萬古黴素可以在一些患者中誘導線性IgA大皰性皮膚病。
最常用的方法是單向免疫擴散法和免疫比濁法,但後者已逐漸代替前者。
檢測機體免疫球蛋白的含量可了解機體的體液免疫功能狀態,幫助診斷免疫增生、免疫缺陷、感染及自身免疫性等多種疾病,具有重要的臨床意義。
1.IgA增高:見於IgA型多發性骨髓瘤、類風濕性關節炎、系統性紅斑狼瘡、肝硬化及某些感染性疾病等。慢性肝病,亞急性或慢性感染性疾病(如結核、真菌感染等),自身免疫性疾病(如SLE、類風濕性關節炎),囊性纖維化,家族性嗜中性粒細胞減少症,乳腺癌,IgA腎病,IgA骨髓瘤等。
2.IgA降低:見於自身免疫病、輸血反應、原發性無丙種球蛋白血症、繼發性免疫缺損等。遺傳性或獲得性抗體缺乏症,免疫缺陷病,選擇性IgA缺乏症,無γ-球蛋白血症,蛋白丟失性腸病,燒傷等。抗IgA抗體現象,免疫抑製劑治療,妊娠後期等。
血清IgA含量正常參考值:0.7~3.8g/L。