離子締合
一種物理現象
離子締合(ionic association),兩個異號電荷離子相互接近到某一臨界距離形成離子對的過程。
離子對為兩個溶劑化異號電荷離子以庫侖力相互吸引,靜電能大於熱運動能,在運動過程中,離子對是一個實體,並具有足夠的穩定性。
離子締合概念是1926年N.J.布耶魯姆提出的,他認為在溶液中凡是異號電荷離子間靜電吸引能超過2kT,即可形成離子對。根據庫侖定律,離子間靜電作用勢能V為:V=|ZiZj|e/Dq(1)式中q為離子間臨界距離;D為溶劑介質常數;e為元電荷;ZiZj為i、j離子的電價。
Debye-Hnckel的活度係數極限公式只能用在高度稀釋的溶液中,濃度稍高,就會出現較大偏差。
偏差可以有兩類:
一類是實驗數據對極限公式有正的偏差,我們用()除以帶有 I 的項來解釋這類偏差;
另一類是負偏差。
離子互吸理論無法解釋,Bjerrum提出離子締合的概念可解決這個困難。離子締合理論與Debye-Huckel 理論相比是另一種物理模型,它把電解質溶液的活度係數理論從低濃度推進到高濃度。
Bjerrum提出的離子締合理論認為,強電解質在水溶液中雖可完全以離子狀態存在。
但在某一定濃度下每個離子並非都能獨立運動,即雖然完全離子化但並非完全解離。這是由於溶液中不同電荷的離子相互靠近到某一臨界距離時,離子間的靜電作用能量可能大於離子熱運動的能量,因而陰、陽離子可能締合成一個新單元,作為一個整體在溶液中運動。我們把這種作用叫作離子締合;由兩個離子締合而成的新單元稱為離子對,三個離子可締合成三離子物,更多離子可締合成離子簇團,等等。離子在溶液中不停地運動,單個的離子物(離子對、三離子物、離子簇團……)存在的時間可能很短,在溶液中每一瞬間都有許多離子締合物分解,同時又有許多離子締合物生成,所以從統計的觀點來看,溶液中總是有一定數量的離子締合物存在。
陽離子與陰離子間的相互作用為
用締合常數表示為:
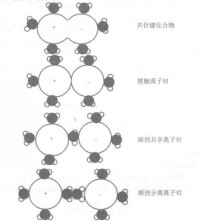
離子對的類型
a(i)是組分i的活度,離子對可以歸納為四類,如圖所示。
(1)配合物一離子通過共價鍵結合;
(2)接觸離子對一離子是接觸的並通過靜電力相互作用;
(3)溶劑分隔的離子對一離子對通過靜電作用聯繫在一起,中間被一個溶劑分子(水分子)分開。
(4)溶劑分隔的離子對一離子對通過靜電作用聯繫在一起,中間被超過一個的溶劑分子(水分子)分開。
假設在體積為V的溶液中,含有i和j兩種相反電荷的離子,如圖所示。令一個j離子為中心離子,距中心離子,一處有一厚度為dr的圓球形殼層。
在這殼層中,i離子存在的幾率W(r)與下述因數成正比:
①溶液中i離子的數目N;
②殼層具有的體積對溶液體積V的比率,即();
③Bollzmann因數(φ是在r距離處的殼層表面的電位)。
因此,可以得出
式中:φ由兩項組成,即中心離子j所引起的在r距離上的電位和離子霧所引起的在r距離上的電位。
Bjerrum假設:當r很小時,離子霧所引起的電位可以忽略,φ電位就是中心離子的電位。為單位體積(1 mL)內i離子的數目,可以得出
由於上述公式右邊有兩個因數是隨著r的增加而變化的,一個是指數項e ,由於i和j有相反的電荷,此指數項隨r的增加而下降;另一個因數是圓球形殼層的體積,顯然隨r的增加而上升。當r接近a時,D很小,,W(r)值很大。
因a是r的最小值,時W(r)有最大值。當r增加時,指數項下降而殼層體積上升。在r值小時下降值遠超過上升值,因而總的情況是W(r)隨r的增加而急速下降。
當r中q值時,下降值等於上升值,W(r)達到一個最低值。此後,W(r)隨 r的增加而上升,併發散到無限值。
銨鹽等大的萃取劑陽離子可與水相中的金屬配合陰離子締合而萃入有機相,例如
體系
萃合物是離子對:
又如,體系,萃合物是離子對:
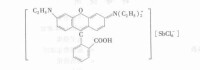
萃合物離子對
(1)離子勢大大降低了,即在大離子外緣球面上電荷密度很小,故水化很弱。
(2)離子很大,根據空腔作用的規律,有利於萃取。
(3)大離子的外緣基團是碳化合物,根據相似性原理,易溶於有機相而不易溶於水相。
(4)大離子的外緣基團把親水性基團包容在內,例如()。
在以上基團中,外緣乙基把親水性的O—H基團包容起來,因而阻礙了後者的水化。如果金屬離子不能生成配陰離子,那麼可以用一個大的有機陰離子去締合金屬陽離子,例如雙(三硝基苯)胺(DPA)在硝基苯中的溶液可以有效地萃取 , 0.1mol/L/DPA(0.01mol/L)-硝基苯,分配比。
DPA的萃取
最簡單的離子締合體系包含體積大的陽離子和陰離子,其大小和結構要使之不具有基本的水合層。相對簡單的化學計量平衡就足以描述這些離子締合體系,在水相中有離子對的解離,而在有機相中有締合。一個例子是用含有氯化四苯基鍾作為離子對的有機溶劑從水相中以高錸酸鹽(Ⅶ)的形式萃取錸(在相互締合的陽離子和陰離子之間的逗號表示離子對的形成)。
對其他大體積陰離子也可進行類似的萃取,如和 。一般的規律(有某些例外)是帶單電荷的大體積陽離子容易與大體積單電荷陰離子形成可萃取的離子締合物。
氯化四苯基鎮的苯取行為在定性和定量方面均與其鍾類似物相同。
因為多價陰離子更容易形成水合物而不太容易萃取,故容易使上述陰離子與鉻酸鹽(Ⅵ)(2-)、鉬酸鹽(Ⅵ)(2-)和鎢酸鹽(Ⅵ)(2-)分離。從酸性溶液中萃取鉻(Ⅳ)無疑是因為酸性介質中有或 的存在,但在二價陰離子佔主導地位的鹼性溶液中則幾乎不能萃取。
如果金屬離子可與鹵素離子絡合而形成大體積絡合物陰離子,則常常可以與適當的大體積陽離子形成可萃取的離子對。
三苯基甲基鍾陽離子可萃取和。
