共找到2條詞條名為化學電源的結果 展開
- 電池
- 程新群主編書籍
化學電源
電池
化學電源又稱電池,是一種能將化學能直接轉變成電能的裝置,它通過化學反應,消耗某種化學物質,輸出電能。常見的電池大多是化學電源。它在國民經濟、科學技術、軍事和日常生活方面均獲得廣泛應用。
化學電池使用面廣,品種繁多,按照其使用性質可分為三類:乾電池、蓄電池、燃料電池。按電池中電解質性質分為:鋰電池、鹼性電池、酸性電池、中性電池。
乾電池也稱一次電池,即電池中的反應物質在進行一次電化學反應放電之後就不能再次使用了。常用的有鋅錳乾電池、鋅汞電池、鎂錳乾電池等。
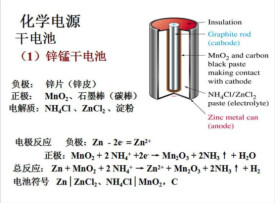
鋅錳乾電池是日常生活中常用的乾電池,其結構如右圖所示:
正極材料:MnO、石墨棒
負極材料:鋅片
電解質:NHCl、ZnCl及澱粉糊狀物
電池符號可表示為
(-)Zn|ZnCl、NH4Cl(糊狀)‖MnO|C(石墨)(+)
化學電源[電池]
化學電源[電池]
化學電源[電池]
鋅錳乾電池的電動勢為1.5V。因產生的NH氣被石墨吸附,引起電動勢下降較快。如果用高導電的糊狀KOH代替NHCl,正極材料改用鋼筒,MnO層緊靠鋼筒,就構成鹼性鋅錳乾電池,由於電池反應沒有氣體產生,內電阻較低,電動勢為1.5V,比較穩定。
蓄電池是可以反覆使用、放電后可以充電使活性物質復原、以便再重新放電的電池,也稱二次電池。其廣泛用於汽車、發電站、火箭等部門。由所用電解質的酸鹼性質不同分為酸性蓄電池和鹼性蓄電池。
酸性鉛蓄電池
化學電源[電池]
化學電源[電池]
化學電源[電池]
放電后,正負極板上都沉積有一層PbSO,放電到一定程度之後又必須進行充電,充電時用一個電壓略高於蓄電池電壓的直流電源與蓄電池相接,將負極上的PbSO還原成Pb,而將正極上的PbSO氧化成PbO,充電時發生放電時的逆反應:
化學電源[電池]
化學電源[電池]
化學電源[電池]
正常情況下,鉛蓄電池的電動勢是2.1V,隨著電池放電生成水,HSO的濃度要降低,故可以通過測量HSO的密度來檢查蓄電池的放電情況。鉛蓄電池具有充放電可逆性好、放電電流大、穩定可靠、價格便宜等優點,缺點是笨重,常用作汽車和柴油機車的啟動電源,坑道、礦山和潛艇的動力電源,以及變電站的備用電源。
鹼性蓄電池
日常生活中用的充電電池就屬於這類。它的體積、電壓都和乾電池差不多,攜帶方便,使用壽命比鉛蓄電池長得多,使用得當可以反覆充放電上千次,但價格比較貴。商品電池中有鎳-鎘(Ni-Cd)和鎳一鐵(Ni-Fe)兩類,它們的電池反應是:
Cd+2NiO(OH)+2HO=2Ni(OH)+Cd(OH)
Fe+2NiO(OH)+2HO=2Ni(OH)+Fe(OH)
反應是在鹼性條件下進行的,所以叫鹼性蓄電池。
燃料電池與前兩類電池的主要差別在於:它不是把還原劑、氧化劑物質全部貯藏在電池內,而是在工作時不斷從外界輸入氧化劑和還原劑,同時將電極反應產物不斷排出電池。燃料電池是直接將燃燒反應的化學能轉化為電能的裝置,能量轉化率高,可達80%以上,而一般火電站熱機效率僅在30%~40%之間。燃料電池具有節約燃料、污染小的特點。
燃料電池以還原劑(氫氣、煤氣、天然氣、甲醇等)為負極反應物,以氧化劑(氧氣、空氣等)為正極反應物,中燃料極、空氣極和電解質溶液構成。電極材料多採用多孔碳、多孔鎳、鉑、鈀等貴重金屬以及聚四氟乙烯,電解質則有鹼性、酸性、熔融鹽和固體電解質等數種。
以鹼性氫氧燃料電池為例,它的燃料極常用多孔性金屬鎳,用它來吸附氫氣。空氣極常用多孔性金屬銀,用它吸附空氣。電解質則由浸有KOH溶液的多孔性塑料製成,其電池符號表示為:
Ni|H|KOH(30%)|O|Ag
負極反應:2H+4OH=4HO+4e
正極反應:O+2HO+4e=4OH
總反應:2H+O=2HO
電池的工作原理是:當向燃料極供給氫氣時,氫氣被吸附並與催化劑作用,放出電子而生成H,而電子經過外電路流向空氣極,電子在空氣極使氧還原為OH,H和OH在電解質溶液中結合成HO。氫氧燃料電池的標準電動勢為1.229V。
氫氧燃料電池目前已應用於航天、軍事通訊、電視中繼站等領域,隨著成本的下降和技術的提高,可望得到進一步的商業化作用。
1991年,我國首創以鋁-空氣-海水為能源的新型電池,稱之為海洋電池。它是一種無污染、長效、穩定可靠的電源。海洋電池徹底改變了以往海上航標燈兩種供電方式:一是一次性電池,如鋅錳電池、鋅銀電池、鋅空(氣)電池等。這些電池體積大,電能低,價格高。二是先充電后給電的二次性電源,如鉛蓄電池,鎳鎘電池等。這種電池要定期充電,工作量大,費用高。
海洋電池,是以鋁合金為電池負極,金屬(Pt、Fe)網為正極,用取之不盡的海水為電解質溶液,它靠海水中的溶解氧與鋁反應產生電能的。我們知道,海水中只含有0.5%的溶解氧,為獲得這部分氧,科學家把正極製成仿魚鰓的網狀結構,以增大表面積,吸收海水中的微量溶解氧。這些氧在海水電解液作用下與鋁反應,源源不斷地產生電能。兩極反應為:
負極:(Al):4Al-12e=4Al
正極:(Pt或Fe等):3O+6HO+12e=12OH
總反應式:4Al+3O十6HO=4Al(OH)↓
海洋電池本身不含電解質溶液和正極活性物質,不放入海洋時,鋁極就不會在空氣中被氧化,可以長期儲存。用時,把電池放入海水中,便可供電,其能量比乾電池高20~50倍。
電池設計使用周期可長達一年以上,避免經常交換電池的麻煩。即使更換,也只是換一塊鋁板,鋁板的大小,可根據實際需要而定。
海洋電池沒有怕壓部件,在海洋下任何深度都可以正常工作。海洋電池,以海水為電解質溶液,不存在污染,是海洋用電設施的能源新秀。
具有高“比能量”和高“比功率”的電池稱為高能電池。所謂“比能量”和“比功率”是指控電池的單位質量或單位體積計算電池所能提供的電能和功率。高能電池發展快、種類多。
(-)銀一鋅電池
電子手錶、液晶顯示的計算器或一個小型的助聽器等所需電流是微安或毫安級的,它們所用的電池體積很小,有“紐扣”電池之稱。它們的電極材料是AgO和Zn,所以叫銀一鋅電池。電極反應和電池反應是:
負極Zn+2OH-2e=ZnO+HO
正極AgO+HO+2e=2Ag+2OH
電池總反應為:Zn+AgO=ZnO+2Ag
利用上述化學反應也可以製作大電流的電池,它具有質量輕、體積小等優點。這類電池已用於宇航、火箭、潛艇等方面。
鋰-二氧化錳非水電解質電池
以鋰為負極的非水電解質電池有幾十種,其中性能最好、最有發展前途的是鋰一二氧化錳非水電解質電池,這種電池以片狀金屬及為負極,電解活性MnO作正極,高氯酸及溶於碳酸丙烯酯和二甲氧基乙烷的混合有機溶劑作為電解質溶液,以聚丙烯為隔膜,電池符號可表示為:
Li|LiClO|MnO|C(石墨)
負極反應:Li=Li+e
正極反應:MnO+Li+e=LiMnO
總反應:Li+MnO=LiMnO
該種電池的電動勢為2.69V,重量輕、體積小、電壓高、比能量大,充電1000次后仍能維持其能力的90%,貯存性能好,已廣泛用於電子計算機、手機、無線電設備等。
鈉+硫電池
它以熔融的鈉作電池的負極,熔融的多硫化鈉和硫作正極,正極物質填充在多孔的碳中,兩極之間用陶瓷管隔開,陶瓷管只允許Na通過。放電分二步進行:
第一步放電
負極:Na=Na+e
正極:2Na+5S+2e=NaS
總反應:2Na+5S=NaS
負極上生成的Na通過陶瓷管,進入正極與硫進行作用,生成NaS,使正極成為S和NaS現混合物,直到將破全部轉化成NaS為止,當正極的硫被消耗完之後轉為第二步放電反應。
第二步放電
負極:2Na=2Na+2e
正極:2Na+4NaS+2e=5NaS
總反應:2Na+4NaS+2e=5NaS
當Na2S5作用完后,電池放電轉入後期工作。
第三步放電
負極:2Na=2Na+2e
正極:2Na+NaS+2e=2NaS
總反應:2Na+NaS=NaS
鈉-硫電池的電動勢為2.08V,可作為機動車輛的動力電池。為使金屬鈉和多硫化鈉保持液態,放電過程應維持在300℃左右。
鋰離子電池的工作原理就是指其充放電原理。當對電池進行充電時,電池的正極上有鋰離子生成,生成的鋰離子經過電解液運動到負極。而作為負極的碳呈層狀結構,它有很多微孔,到達負極的鋰離子就嵌入到碳層的微孔中,嵌入的鋰離子越多,充電容量越高。同樣道理,當對電池進行放電時(即我們使用電池的過程),嵌在負極碳層中的鋰離子脫出,又運動回到正極。回到正極的鋰離子越多,放電容量越高。我們通常所說的電池容量指的就是放電容量。不難看出,在鋰離子電池的充放電過程中,鋰離子處於從正極→負極→正極的運動狀態。如果我們把鋰離子電池形象地比喻為一把搖椅,搖椅的兩端為電池的兩極,而鋰離子就象優秀的運動健將,在搖椅的兩端來回奔跑。所以,專家們又給了鋰離子電池一個可愛的名字搖椅式電池。
微生物燃料電池是可以將有機物中的化學能直接轉化為電能的反應器裝置。
隨著研究的深入,微生物燃料電池已可以利用各種污水中所富含有機物質進行電能的生產。它的發展不僅可以緩解日益緊張的能源危機以及傳統能源所帶來的溫室效應,同時也可以處理生產和生活中的各種污水。因此微生物燃料電池是一種無污染、清潔的新型能源技術,其研究和開發必將受到越來越多的關注。