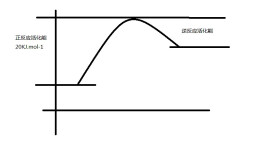
吸熱反應
吸熱反應
吸熱反應是指在過程中吸收熱量的化學反應。例如赤熱的炭和水蒸氣作用生成水煤氣(等體積的氫和一氧化碳的混合物)的反應。化學反應只有少數是吸熱的。吸收熱在熱化學方程式中用負號(一)表示。迴流reflux在精餾過程中由塔頂蒸氣凝縮而得的液體中再由塔頂回入塔內的部分。可以補充易揮發組分,使得精餾操作能連續進行。
生成物中的化學鍵的能量(鍵能)越強,穩定性越強;鍵能越弱,穩定性越差。
例如:C+H2O=(高溫)CO+H2吸熱反應示意圖
分解反應一般為吸熱反應,如2NaHCO3→(加熱)Na2CO3+H2O+CO2↑。
注意:不是需要加熱的反應都是吸熱反應,燃燒大多數要“點燃”,都是放熱反應。
吸熱反應就是在化學變化中,需要不斷吸收大量熱量的反應。
不是所有需要使用催化劑的反應都是吸熱反應。C+CO2=(高溫)2CO是吸熱反應。
有些反應在開始時,需要提供一定的條件,如加熱、點燃等,一旦反應進行開了,去掉條件反應繼續進行,這樣的反應是放熱反應。
有時根據需要,在化學反應方程式的右側標明是吸熱還是放熱,通常是+Q吸熱,-Q是放熱
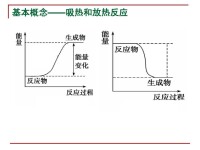
(圖)吸熱和放熱反應
生成物中的化學鍵的能量越強,穩定性越差,能量越弱,穩定性越好。
例如:C+H2O=CO+H2
分解反應一般為吸熱反應,如2NaHCO3=(加熱)Na2CO3+H2O+CO2。
注意:不是需要加熱的反應都是吸熱反應,燃燒大多數要"點燃",都是放熱反應
常見的放熱反應:
1.一切燃燒,以及部分氧化(如氨氣氧化)
2.中和、沉澱(不全是)
3.多數化和,如SO3+H2O,NH3+HCl(但H2+I2,合成NH3吸熱)
4.特別劇烈的反應,如電石和水
化學上把吸收熱量的化學反應叫做吸熱反應。
(1) ①幾個常見的反應,如:
2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
C+H2O(g)=(高溫)CO+H2
C(s)+CO2(g)=(高溫)2CO
I2+H2=2HI(此反應為可逆反應,因為生成的碘化氫不穩定)
②多數的分解反應,如:
CaCO3=(高溫)CaO+CO2↑
CuSO4·5H2O=CuSO4+5H2O
(2)電離。
(3)鹽類水解。此時必為吸熱反應。如:銨根水解即為吸熱
C,H2 ,CO做還原劑的反應都吸熱
闢謠:判斷反應熱效應的兩個標準是實驗實測以及通過熱力學進行計算,而C、H2、CO還原很多情況都是放熱反應,如以下實例
反應1:CuO(s)+H2(g)=Cu(s)+H2O(g)
反應2:CuO(s)+CO(g)=Cu(s)+CO2(g)
反應3:CuO(s)+1/2C(石墨)=Cu(s)+1/2CO2(g)
計算化學反應熱效應可以直接使用ΔH
相應物質標準生成焓:單位:kJ/mol
分子式 標準生成焓
H2O(g) -241.82
C(石墨) 0.00
H2(g) 0.00
CO(g) -110.53
CO2(g) -393.51
Cu(s) 0.00
CuO(cr) -157.30
數據代入計算可知:
ΔH1=0+(-241.818)-(-157.3)-(0)=-84.518<0,即反應放熱
ΔH2=0+(-393.509)-(-110.525)-(-157.3)=-125.684<0,即反應放熱
ΔH3=0.5×(-393.509)+0-(-157.3)-0=-236.209<0,即反應放熱
綜上可證這三個反應都是放熱反應,即本詞條原有的,網路上流傳的所謂“C,H2,CO做還原劑的反應(吸熱)”實質系謠言