麥克斯韋速度分佈律
麥克斯韋速度分佈律
目錄
處於平衡狀態下的理想氣體分子以不同的速度運動,由於碰撞,每個分子的速度都不斷地改變,使分子具有各種速度。因為分子數目很大,分子速度的大小和方向是無規的,所以無法知道具有確定速度υ的分子數是多少,但可知道速度在與之間的分子數是多少。麥克斯韋首先得到,在平衡狀態下,當氣體分子間相互作用可以忽略時,分佈在任一速率區間內的分子數與總分子數的比率為
即速率分佈函數為
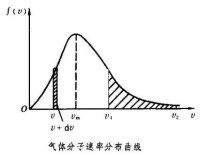
式中T是氣體的溫度,m是分子的質量,k是玻耳茲曼常數。圖中的曲線叫速率分佈曲線,它描繪出氣體分子按速率的分佈情況。中任一區間內曲線下的窄條面積與總面積的比表示速率分佈在這個區間內的分子數的比率。由此看出,速率很大和很小的分子所佔的比率都很小。1920年O.斯特恩最先用原子束(分子束)實驗直接驗證了麥克斯韋速率分佈律的正確性。
① 最可幾速率。定義為概率最大的速率。即在這速率下,分佈函數具有極大值。此時② 均方根速率。定義為速率平方平均的平方根值。可得
③ 平均速率尌。定義為速率的算術平均值。有
考慮到氣體分子速度方向以後,就可以得出氣體分子速度的分佈律。用v表示氣體分子的速度矢量,、、分別表示v沿直角坐標軸的分量。從理論上可推出:在平衡狀態下,當氣體分子間的相互作用可以忽略時,速度分量在內,在內,在內的分子數的比率為。
這個結論叫做麥克斯韋速度分佈律。
1872年,玻耳茲曼創立了系統的氣體輸運理論,從研究非平衡態分佈函數著手,建立了H定理(見統計物理學)。玻耳茲曼根據H定理證明,在達到平衡狀態時,氣體分子的速度分佈趨於麥克斯韋分佈。