熔解熱
熔解熱
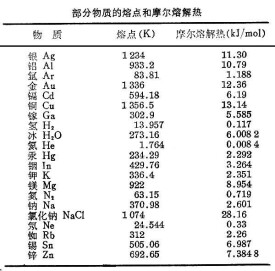
熔解熱(fusion, heat of)是指在一定的壓強下,單位質量物質從固相轉變為同溫度的液相的過程中所吸收的熱量。在一定的壓強下,結晶的 固體要升高到一定的溫度才熔解,在熔解過程中物質的溫度保持不變,這一溫度稱為熔點。如在大氣壓下,冰熔解時溫度保持為0℃,而且由冰熔化而得的水也保持為0℃,直到冰全部熔解成水為止。
在晶體中,粒子之間的相互作用力使粒子規則地聚集在一起,形成空間點陣,粒子只能在它的平衡位置附近作微小振動。熔解過程中吸收的熱量(熔解熱),從微觀上看,就是外界給粒子提供能量,使它的熱振動加劇,直至粒子之間的引力再不能維持它的有序排列,而逐漸轉向無序,熔解為液體。可見,對於晶體,熔解熱就是破壞晶體點陣結構所需要的能量,因此熔解熱可以用來衡量晶體內聚能的大小。
利用克拉珀龍方程可以求得熔點隨壓強的改變,以及熔解熱隨溫度的改變等。一般來說,物質的熔點隨壓強的改變是不顯著的,熔解熱與壓強基本無關。
熔解熱和結晶熱在數值上相等,但在熱力學計算式中結晶熱前需冠以負號。
如果用λ表示物質的熔解熱,m表示物質的質量,Q表示熔解時所需要吸收的熱量,則
Q=λm
熔解熱的量度單位是J/Kg或J/mol。由於歷史原因,至今有些書上仍用cal/g作量度單位。測量熔點較高的物體的熔解熱比較困難,對於熔點較低的物體,可以用量熱器來測定。