熔解
熔解
熔解,是指物質由固相轉變為液相的相變過程。它是凝固的相反過程。在一定的壓強下,固體(晶體)要加熱到一定溫度(熔點)才能熔解,熔解過程中溫度不變,從外界吸熱。
在熔解過程中,要吸收熱量,這部分熱量是熔解熱。熔解過程吸收熱量的多少,只能影響熔解的快慢,而不能影響熔解溫度的高低,即熔解過程中溫度不變,直至全部晶體都變成液體時為止,晶體熔解時對應的溫度,稱為熔點。
物質從固相轉變為液相的過程稱為熔解,在一定壓強下,晶體在確定的溫度下熔解,這一溫度稱為晶體在該壓強下的熔點,熔解過程中系統的溫度保持不變,但要吸收熱量。熔解單位質量晶體所需的熱量稱為熔解熱,對晶體來說,熔解是粒子由規則排列轉向非規則排列的過程,實質上是由遠程有序轉為遠程無序的過程,熔解熱是破壞點陣結構所需的能量,因而熔解熱可以用來衡量結合能的大小。
固態熔解特點是物質的物理性質發生顯著變化,主要是飽和蒸汽壓、電阻率以及熔解氣體能力的變化,特別是體積的變化。
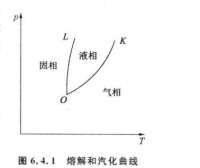
溶解和汽化曲線
在熔解過程中,吸收熱量的多少,只能影響熔解的快慢,而不能影響熔解溫度的高低。這說明晶體在熔解和凝固的過程中具有共同的特徵。溫度保持不變,晶體的液態和固態之間有著明顯的界限。這是由於晶體的分子是按一定的規則排列成為空間點陣的。分子只能在平衡位置附近不停地振動,因此,它具有動能;同時,在空間點陣中,由於分子之間相互作用,它又同時具有勢能。晶體在開始熔解之前,從熱源獲得的能量,主要是轉變為分子的動能,因而使物質的溫度升高。但在熔解開始時,熱源傳遞給它的能量,是使分子的有規則的排列發生變化,分子之間的距離增大以及分子離開原來的平衡位置移動。這樣加熱的能量就用來克服分子之間的引力做功,使分子結構渙散而呈現液態。也就是說,在破壞晶體空間點陣的過程中,熱源傳入的能量主要轉變為分子之間的勢能,分子動能的變化很小,因此,物質的溫度也就沒有顯著的改變。所以熔解過程是在一定溫度下進行的。
晶體的熔解是其晶格粒子由規則排列轉化為無序狀態的過程,熔解熱是破壞點陣結構所需的能量,可用來衡量晶體結合能的大小。
不同晶體的熔點不同,同一晶體的熔點還與熔解時的壓強有關。在 p-T 圖上表示熔點與壓強關係的曲線稱為熔解曲線,它是固、液相的分界線,曲線上各點表示固、液相平衡共存的各個狀態。大多數晶體熔解時體積膨脹,熔點隨壓強增大而降低。熔點還與晶體純度有密切關係,少量雜質往往可顯著降低其熔點,合金的熔點就往往低於其中各金屬成分的最低熔點。
非晶體固體如玻璃、石蠟、樹脂、瀝青、塑料等的熔解並不在特定溫度下進行,無熔點可言。它們在熔解過程中隨著溫度的上升逐漸軟化,最終變成液體。
非晶體在熔解過程中,隨溫度的升高而逐漸軟化,最後全部變為液體,所以熔解過程不是與某一確定溫度相對應,而是與某個溫度範圍相對應。因為非晶體物質的分子結構跟液體相似,它的分子排列是混亂而沒有規則的,即使由於它的粘滯性很大,能夠保持一定的形狀,但是實際上它並不具有空間點陣的結構。熱源傳遞給它的能量,主要是轉變為分子的動能。所以在任何情況下,只要有能量輸入,它的溫度就要升高。因此它沒有一定的熔解溫度,並且在熔解過程中溫度是不斷上升的。
固態在熔解時,物質的物理性質要發生顯著變化,其中最主要的是飽和蒸汽壓、電阻率以及熔解氣體能力的變化,特別是體積的變化。例如,冰總是浮在水面上,嚴冬季節,盛滿水的瓶子因凍結而將杯脹裂。固體石蠟放入熔解的液體石蠟里,會下沉到底部。從而得出固態熔解成液態,或液態凝固成固態時,體積和密度通常是要發生變化的。大多數物質如石蠟、銅、鋅、錫等,在溶解時體積變大,在凝固時體積要縮小。這是因為在晶體內分子有規則排列時所佔的體積要比在液體內分子雜亂無章排列時所佔的體積小些。但也有少數物質例外,例如,冰、鉍和銻等,它們在凝固時體積反而變大,熔解時體積反而縮小。利用這一特點,在鑄鉛字時,常常要在鉛中加入一些鉍、銻等金屬,使其在凝固時膨脹,字跡清晰。
熔解是物質從固態轉化為液態的過程。對於純金屬,當其在一定的壓力下加熱到一定的溫度(熔點)時,便開始發生熔解。在熔解過程中雖然吸收熱量,但溫度保持不變,直到全部變為液體為止。純金屬的熔解速度取決於熔解過程的傳熱速度;而對於合金,由於它的熔點是成分的函數,因而只有當合金表面的溫度和成分達到液相線以上的溫度和成分時,合金才能夠開始熔解。因此,合金的熔解速度同時受傳熱速度和元素的遷移速度所控制。
1、廢鋼熔解的一般過程
在轉爐鍊鋼過程中,常加人一定量的廢鋼作為原料來提高鋼的產量。加入到轉爐鐵水中的廢鋼在鐵水中的熔解過程可分為四個階段:(1)熔體在廢鋼表面形成凝固殼層;(2)凝固殼層熔化;(3)加熱廢鋼表面層至其液相線溫度;(4)過熱到廢鋼表面,達液相線溫度的廢鋼強烈熔化。其中,前三個階段構成了第一個加熱期,這時加入的廢鋼內部吸入的熱量超過了鐵水供給的熱量,因而在廢鋼表面形成了凝固殼層。第四個階段則構成了第二個加熱期,外部的熱通量超過了內部的熱通量,因而凝固層被熔化而進入鐵水中。
由石灰石煅燒成的石灰具有多孔結構。在轉爐內,當初期渣(FeO-SiO系)形成后,它能通過石灰表面向其內部空隙擴散使石灰解體,解體後分高形成的多個石灰單晶粒分佈在熔渣中並迅速完全熔解,使熔渣的鹼性提高。
純石灰的熔點約為2600℃,比渣液的溫度高。因此,要使石灰在渣中熔解,需要在渣與石灰的界面上生成低熔點的中間相。為實現此目的,需要使渣中FeO、MnO等向石灰表面擴散,在石灰表面層生成mCaO ·nFeO、mCaO ·nFeO、 CaO ·MnO等易熔中間相,因此,石灰的熔解速度與渣液中氧化鐵的含量、渣液的流動性以及石灰的結晶結構等因家有關。特別是,當渣液中FeO <20%時,在石灰表面上易生成高熔點難熔相2CaO ·SiO(=(CS),它會使石灰的熔解速度減慢。
渣中(FeO)的擴散比(SiO)的擴散快得多,因而前者能迅速溶解到石灰內,形成鐵酸鈣低熔點化合物,從而使石灰熔解。此外,渣中的(SiO)能與石灰外層的CaO作用,形成高熔點的CS緻密殼層,能阻礙(FeO)向石灰內擴散,使石灰的熔解速度下降。因此,在石灰熔解過程中,應設法阻比或減慢硅酸鈣殼層的形成或設法增大它們在請中的溶解度。能夠形成低熔點化合物的(FeO)的存在能夠破壞礎酸鈣的結構,因此應盡量促使其快速形成並提高其含量。熔解完半的CaO經過石灰外的邊界層向熔查中擴散,它是石灰在渣中熔解速度的限制環節,所以加強熔池攪拌能夠加速其熔解過程。
熔解和凝固
物質從固態變成液態叫做熔解,從液態變成固態叫做凝固。
晶體有一定的熔解溫度——熔點。晶體在熔解過程中,當溫度升高到熔點時,晶體才開始熔解,在熔解過程中溫度保持不變,到全部熔解后,溫度才繼續上升,其逆過程是液體溫度降低到熔點時才開始凝固,凝固過程中,溫度也保持不變,到全部凝固后,溫度才繼續下降,非晶體沒有一定的熔點,溫度升高時,非晶體先是由硬變軟,再逐漸變成黏稠狀液體,最後逐漸變成液體,整個過程中溫度不斷升高,冷卻時情況正好相反。
實驗表明,大多數物質在熔解時體積膨脹,凝固時體積縮小,其熔點即凝固點隨壓強的增大而升高;少數物質如水、灰鑄鐵、銻、鉍等熔解時體積縮小,凝同時體積膨脹,其熔點即凝固點隨壓強的增加而降低,不過壓強對熔點的影響並不顯著,如每增加1 atm,冰的熔點才降低0.0075℃。
另外,純物質中摻進另一種物質,熔點要降低,如冰和食鹽的混合物,熔點可以降低到-20℃以下。
晶體在熔解過程中不斷從外界吸收熱量,但溫度不變,吸收的熱量主要用於破壞晶體的空間點陣,增加分子勢能。在具體計算中,一般可忽略其體積的變化(即忽略對外界做功這項)。我們把單位質量的某種物質熔解成同溫度的液體時吸收的熱量,叫做這種物質的熔解熱,符號A,單位J·kg ;液體凝固時要放出熱量,單位質量的某種物質凝固時放出的熱量等於它的熔解熱。
