離子選擇性電極
衡量電極優劣的指標
離子選擇性電極是一類利用膜電勢測定溶液中離子的活度或濃度的電化學感測器,當它和含待測離子的溶液接觸時,在它的敏感膜和溶液的相界面上產生與該離子活度直接有關的膜電勢。離子選擇性電極也稱膜電極,這類電極有一層特殊的電極膜,電極膜對特定的離子具有選擇性響應,電極膜的電位與待測離子含量之間的關係符合能斯特公式。這類電極由於具有選擇性好、平衡時間短的特點,是電位分析法用得最多的指示電極。
1906年由R.克里默最早研究的,隨後由德國的F.哈伯等人製成的測量pH值的玻璃電極是第一種離子選擇性電極。1934年B.倫吉爾等觀察到含氧化鋁或三氧化二硼的玻璃電極對鈉也有響應。50年代末,G.艾森曼等製成了對氫離子以外的其他陽離子有能斯脫響應的玻璃電極。1936年H.J.C.坦德羅觀察了螢石膜對的響應,1937年I.M.科爾托夫用鹵化銀薄片試製了鹵素離子電極。1961年匈牙利的E.蓬戈系統研製了以硅橡膠等為惰性基體的,對包括、 和鹵素離子在內的多種離子有響應的沉澱膜電極。1966年美國的M.S.弗蘭特和J.W.羅斯用氟化鑭單晶製成高選擇性的氟離子電極,這是離子選擇性電極發展史上的重要貢獻;次年羅斯又製成第一種液體離子交換型的鈣離子電極。與此同時,瑞士的西蒙學派通過從抗菌素製備鉀電極,開始了另一類重要的電極,即中性載體膜電極的研究。到60年代末,離子選擇性電極的商品已有20種左右,這一分析技術也開始成為電化學分析法中的一個獨立的分支學科。
離子選擇性電極
當一片電化學膜將兩種電解質溶液隔開時,如果膜對任何離子的通過均無阻礙,而只起防止兩種溶液迅速混合的作用時,則在膜兩側的溶液間就產生一個來自溶液中各離子的濃度和淌度差別的擴散電勢,稱為液體接界電勢。另外一種情況是,如果膜至少完全阻止其中的一種離子通過,則產生所謂唐南電勢。離子選擇電極的敏感膜是一種選擇性穿透膜,它對不同離子的穿透只有相對選擇性而無專一性,因此,膜電勢介於上述兩種極端情況之間。
TMS 理論的基本假設是:膜的總電勢由三部分組成,它等於膜兩側面與溶液界面上的兩個相界面電勢與膜內的擴散電勢之和。在此基礎上,導出了包含唐南項與漢德森項的膜電勢方程式。艾森曼等通過求解能斯脫-普朗克流量方程,分別推導出不同類型電極的膜電勢方程式。
在電極膜只允許帶同樣電荷的離子通過而不允許帶相反電荷的離子和溶劑分子通過,穿過膜的離子均有理想行為和膜電流為零的前提下,可用統一的公式來表示膜電勢:
(1)式中a媴和a徎為i離子在溶液1和2中的活度;a徾和a徿為總數為N種的j離子在溶液1和2中的活度;Zi和Zj為離子i與j的電荷數;T為絕對溫度;R為氣體常數;F為法拉第常數;Kij為電極對主要離子i相對於其他離子j的選擇性係數。當溶液2中的組成不變時,a徎和a徿均為恆定值,則得:
上式就是尼科爾斯基-艾森曼方程式,是離子選擇性電極分析中的基本方程式。
如果電極對i離子有高度的選擇性,即所有的Kij均接近於零,則上式變成:
其形式與能斯脫公式完全一致。這就是人們習慣於用能斯脫關係來描述離子選擇性電極的響應特性的原因。
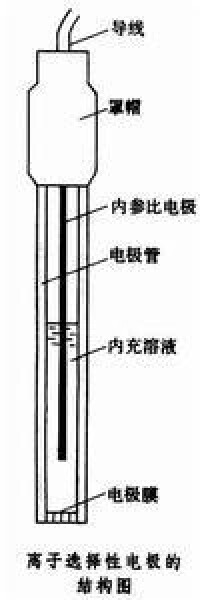
結構
電勢測量
離子選擇性電極是一個半電池(氣敏電極例外),它的電勢不能單獨測量,而必須和適時的外參比電極組成完整的電化學電池,然後測量電池的電動勢,它包括以下幾項
式中為內參比電極的電勢;
與為外參電極的電勢及其液接部分的液接電勢。
在一般測量中,上述三項都要求保持不變,因此電動勢E與之間只差一個常數項,它的變化完全能反映的變化。
離子選擇性電極的基本特性是衡量電極優劣的指標。
電極在對一種主要離子產生響應時,會受到其他離子,包括帶有相同和相反電荷的離子的干擾。公式(1)反映了相同電荷離子對膜電勢的影響,它用選擇性係數Kij來表示,此值愈小,電極對i離子的選擇性愈高,一般要求Kij值在10-3以下。Kij不是一個嚴格的常數,它隨測定的方法和條件而異,因此只能用來估量電極對不同離子響應的相對大小,而不能用來定量校正干擾離子所引起的電勢變化。電極的選擇性主要決定於電極活性材料的物理、化學性質和膜的組成。
電極有很寬的測量範圍,一般有幾個數量級。根據膜電勢的公式,以電勢對離子活度的對數作圖,可得一直線,其斜率為。這就是校正曲線。實際上,當活度ai很低時,由於膜物質本身的溶解以及干擾離子的影響等,校正曲線明顯彎曲。電極的線性響應範圍是指校正曲線的直線部分,它是定量分析的基礎,大多數電極的響應範圍為,個別電極達10-7Μ,所以測定的靈敏度往往滿足不了痕量分析的要求。在採用離子緩衝液時,電極的線性響應範圍可大大擴展(如銀電極可達10-20Μ),使電極可用於理論研究。
電極的響應時間有不同的表示方法,浸入法測定的響應時間是指從電極接觸溶液開始至達到穩定電勢值(±1毫伏)的時間;注射法則通過迅速改變測量溶液濃度,測量達到電勢最終變化值ΔE的固定百分數的時間,如t90,t95等。電極的響應時間隨電極種類、溶液的濃度、溫度、電極處理方法而異。一般,固態電極響應較快,有的只有幾毫秒(如硫化銀電極);液膜電極響應較慢,通常從幾秒到幾分鐘。電極的響應速度是判斷電極能否用於連續自動分析的重要參數。
通過測量電勢直接計算離子的活度或濃度,其準確度不高,且受到離子價態的限制。理論計算表明,對於一價離子,1毫伏的測量誤差會導致產生±4%的濃度相對誤差。離子價態增加,誤差也成倍增加。此外,電極在不同濃度範圍有相同的準確度,因此它較適用於低濃度組分的測定。
電極的內阻較高,一般在幾百千歐到幾兆歐之間,玻璃電極和微電極則更高,所以要求使用高輸入阻抗的測量儀器。一般,電極壽命在數月至數年間。
目前尚不統一。1975年國際純粹與應用化學聯合會推薦的分類法為:
其中一種分法:
原電極(基本電極或主體電極)晶體膜電極單晶膜電極(入氟離子選擇性電極)多晶膜電極 離子選擇性電極非晶體膜電極剛性基質電極(如玻璃膜電極)流動載體電極(如鈣離子選擇性電極)敏化電極氣敏電極(如氨氣敏電極)酶電極
一些最重要的電極及其主要性能見表。
又叫氫離子選擇性電極
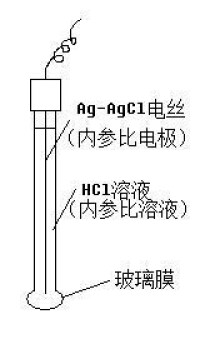
選擇性電極
玻璃電極使用前,必須在純水中浸泡一段時間.由於玻璃的硅氧結構與H+的鍵合作用大於,浸泡過程中,玻璃膜表面的被取代,形成了一層很薄的水合硅膠層(因在玻璃膜的外部,也稱外水合硅膠層)。水合硅膠層中的氫離子或獨於水中氫離子活動存在差異,在水合硅膠層與水的接觸界面形成了電位差。
當浸泡的玻璃電極進入待測溶液時,由於待測溶液與純水的氫離子活度的差異,氫離子在水和硅膠層與待測溶液兩項之間重新進行交換,水合硅膠層與待測溶液的接觸界面形成了新的電位差(記作φ外),這個電位差與待測溶液中氫離子活度a外有關。
在電極內部,由於玻璃膜始終浸泡在內參比溶液中,在玻璃膜的內表面也形成了一層內水合硅膠層,內水合硅膠層與內參比溶液的接觸界面也存在電位差(記作φ內)。這個電位差與內參比溶液中氫離子的活度a內有關,但由於內參比溶液中的氫離子活度是一定的,這個電位差也是一定的。
既然外水合硅膠層與待測溶液、內水合硅膠層與內參比溶液的接觸界面均存在電位差,那麼,跨越玻璃膜兩端(從內參比溶液經玻璃膜到外部待測溶液)也存在電位差,這個電位差稱作膜電位,記作φ膜。顯然,膜電位等於上述兩個電位差的代數和,即
因為與有關,而有是一定的,所以,與有關。
主要有兩類方法:
①直接電勢法,通過測量電勢,由校正曲線或計演演算法求得待測物的濃度。為使樣品和標準溶液中的離子的活度係數一致,要加入含高濃度惰性電解質的離子強度調節緩衝液。
②電位滴定法,利用離子選擇性電極作為電位滴定的指示電極,它能達到與一般容量法相同的高準確度。由於可用電極指示待測離子和滴定劑離子甚至指示劑離子的濃度變化,所以該法擴大了電極的應用範圍。
離子選擇性電極是一種簡單、迅速、能用於有色和混濁溶液的非破壞性分析工具,它不要求複雜的儀器,可以分辨不同離子的存在形式,能測量少到幾微升的樣品,所以十分適用於野外分析和現場自動連續監測。與其他分析方法相比,它在陰離子分析方面特別具有競爭能力。電極對活度產生響應這一點也有特殊意義,使它不但可用作絡合物化學和動力學的研究工具,而且通過電極的微型化已被用於直接觀察體液甚至細胞內某些重要離子的活度變化。離子選擇性電極的分析對象十分廣泛,它已成功地應用於環境監測、水質和土壤分析、臨床化驗、海洋考察、工業流程式控制制以及地質、冶金、農業、食品和藥物分析等領域。