酸式鹽
可電離出氫離子的鹽化合物
可電離出氫離子的鹽,通常是酸中的氫離子部分被中和的產物,如碳酸氫鈉、硫酸氫鉀等。,酸式鹽溶液可呈酸性,也可呈鹼性,其酸鹼性取決於該酸式根給出或接受質子的傾向強弱,“給出”強於“接受”,水溶液呈酸性,如磷酸二氫鈉;反之則呈鹼性,如碳酸氫鈉。
酸式鹽有廣泛的用途,碳酸氫鈉(又稱小蘇打)在工業上和日常生活中用作發泡劑等碳酸氫銨可做肥料,磷酸氫鹽是肥料的主要成分。
通俗地講,強酸的酸式鹽都是酸性,中強酸的一鈉鹽(或者一鉀鹽)都是酸性,此外的鈉鹽或鉀鹽(包括所有弱酸的酸式鹽)都是鹼性。具體劃分:
① 水溶液呈酸性的酸式鹽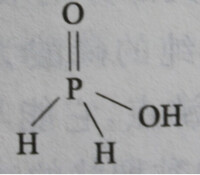 強鹼強酸的酸式鹽:如 ,在其水溶液中發生完全電離,因此溶液呈酸性;
強鹼強酸的酸式鹽:如 ,在其水溶液中發生完全電離,因此溶液呈酸性;

次磷酸結構式
強酸弱鹼的酸式鹽:強酸和弱鹼生成的鹽:如 ,溶液呈酸性。溶液顯酸性是由於的電離,電離程度遠遠大於水解,並一定程度上抑制水解,所以不要以為酸性來自銨根水解。
強鹼弱酸酸式鹽:酸根又電離又水解,需要查看Ka值計算,不過中強酸第一個氫離子被取代的酸式鹽基本都是酸性,含有酚羥基和羧基的多元酸可能不符合。
②水溶液呈鹼性的酸式鹽:
一般為強鹼弱酸的酸式鹽,如:--鹽,--鹽,因“電離”趨勢小於“水解”趨勢,所以溶液呈鹼性。
1、水中的溶解性。一般來說,在相同溫度下,不溶性正鹽對應的酸式鹽的溶解度比正鹽的大,如難溶於水,易溶於水;磷酸的鈣鹽溶解性由大到小為:>>。可溶性正鹽對應的酸式鹽溶解度比其正鹽的小,如Na2CO3的溶解性大於,的溶解性大於。正因為如此,向飽和的碳酸鈉溶液中通入過量的二氧化碳有沉澱生成,其反應的方程式為:
(飽和)++=↓
2、與鹼的反應。酸式鹽與鹼均可反應,弱酸酸式鹽既能與強酸又能與強鹼反應。中學常見的酸式酸根有:、、、、等,常見的反應離子方程式為:
(但要注意(次磷酸)為強一元酸,故為正鹽,其中的 H與P直接相連,無法產生像碳酸鈉兩個H一樣的作用)。
3、與酸的反應。強酸的酸式鹽與酸不發生複分解反應。儘管是鹽,但可做強酸用,其水溶液具有酸的通性,如可與活潑性在氫之前的金屬反應,生成氫氣;可與反應,生成。弱酸的酸式鹽與對應的酸不反應(例外),可與酸性比其強的酸反應,生成新酸和新鹽,(強酸制弱酸原理)如可與HCl、、在水溶液中反應。
常見的酸酸性強弱為: >>>> > (醋酸)>> >>。
常見酸式酸根與酸反應的離子方程式有:
4、酸式鹽電離和水解。強酸的酸式鹽只能電離,不能發生水解,如的水溶液一定顯酸性;弱酸的酸式鹽既可電離,也可水解,其水溶液的酸鹼性將由電離和水解以及陽離子等方面決定。中學不研究弱酸弱鹼鹽溶液的酸鹼性,因此,對於強鹼弱酸對應的酸式鹽溶液的酸鹼性就由電離和水解兩個方面來決定。當電離大於水解的趨勢,其水溶液顯酸性,如、;當水解大於電離的趨勢,其水溶液顯鹼性,如、、。當然,電離和水解的趨勢哪個大最根本的是要由實驗來判斷。但是對中學化學中常見的幾種,我們要記住。
5、對熱的穩定性。一般說來,熱穩定性大小順序為:可溶性正鹽>不可溶正鹽>酸式鹽>多元酸(對同一類酸而言)。如:
難分解 ,而碳酸氫鈉受熱易分解
,
強鹼弱酸的酸式鹽水解程度小於強鹼弱酸的正鹽水解程度。如和,水解只有一步:,[OH]>[H]。顯然,兩種相同濃度的溶液其鹼性:<。
1、多元弱酸與少量鹼反應,如:
如果鹼的量較大會生成正鹽。
2、弱酸正鹽與對應的弱酸反應。通入相應的氣體或加入過量相應的酸可以把正鹽全部轉化為酸式鹽,這是製取酸式鹽的最佳方法。如:
在中學階段,所有酸式鹽都定義為可溶於水,如要出沉澱,就必須超過溶解度,並非一定要不溶於水才會出沉澱。例如向碳酸鈉飽和溶液中通入二氧化碳,就會析出碳酸氫鈉沉澱,方程式為:
